题目内容
室温时,下列各选项中所述的两个量,前者一定大于后者的是( )
| A、1L 0.3mol/L CH3COOH溶液和3L 0.1mol/L CH3COOH溶液中的H+数 |
| B、pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C、pH=12的氨水和NaOH溶液的导电能力 |
| D、等pH值的碳酸钠溶液和醋酸钠溶液的物质的量浓度 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.相同温度下,醋酸的浓度越大其电离程度越小;
B.醋酸是弱电解质,在水溶液里部分电离,氯化氢是强电解质,在水溶液里完全电离;
C.溶液的导电能力与离子浓度成正比;
D.pH相等的弱酸的钠盐溶液,酸根离子水解程度越大,其盐的浓度越小.
B.醋酸是弱电解质,在水溶液里部分电离,氯化氢是强电解质,在水溶液里完全电离;
C.溶液的导电能力与离子浓度成正比;
D.pH相等的弱酸的钠盐溶液,酸根离子水解程度越大,其盐的浓度越小.
解答:
解:A.相同温度下,醋酸的浓度越大其电离程度越小,所以1L 0.3mol/L CH3COOH溶液和3L 0.1mol/L CH3COOH溶液中的H+数前者小于后者,故A错误;
B.醋酸是弱电解质,氯化氢是强电解质,pH=1的CH3COOH溶液和盐酸的物质的量浓度,醋酸浓度大于盐酸,故B正确;
C.溶液的导电能力与离子浓度成正比,两种溶液中离子浓度相等,所以其导电能力相等,故C错误;
D.pH相等的弱酸的钠盐溶液,酸根离子水解程度越大,其盐的浓度越小,碳酸根离子水解程度大于醋酸根离子,所以等pH值的碳酸钠溶液和醋酸钠溶液的物质的量浓度前者小于后者,故D错误;
故选B.
B.醋酸是弱电解质,氯化氢是强电解质,pH=1的CH3COOH溶液和盐酸的物质的量浓度,醋酸浓度大于盐酸,故B正确;
C.溶液的导电能力与离子浓度成正比,两种溶液中离子浓度相等,所以其导电能力相等,故C错误;
D.pH相等的弱酸的钠盐溶液,酸根离子水解程度越大,其盐的浓度越小,碳酸根离子水解程度大于醋酸根离子,所以等pH值的碳酸钠溶液和醋酸钠溶液的物质的量浓度前者小于后者,故D错误;
故选B.
点评:本题考查了弱电解质的电离及盐类水解,明确同一弱电解质的电离与溶液浓度的关系、弱酸根离子水解程度与其溶液碱性强弱的关系是解本题关键,易错选项是C,注意溶液的导电能力与离子浓度成正比,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,下列说法正确的是( )
| A、生成1mol H3AsO4时,转移电子个数为10NA |
| B、将该反应设计成一原电池,则NO2应该在负极附近逸出 |
| C、该反应的氧化产物为S和H3AsO4 |
| D、该反应中HNO3表现酸性和强氧化性 |
下列叙述正确的是( )
| A、微粒abXn-中中子数为b-a-n | ||||
B、反应SiO2+3C
| ||||
| C、非金属氧化物一定属于非电解质 | ||||
| D、金属氧化物可能属于酸性氧化物 |
下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH═CH2 ③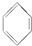 ④CH3CH3.
④CH3CH3.
①SO2 ②CH3CH2CH═CH2 ③
 ④CH3CH3.
④CH3CH3.| A、①②③④ | B、③④ |
| C、①②④ | D、①② |
下列离子方程式书写正确的是( )
A、碳酸钡与盐酸反应:CO
| ||||
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ | ||||
C、硫酸镁溶液与氢氧化钡溶液反应:MgSO4+2OH-═Mg(OH)2↓+SO
| ||||
D、碳酸氢钠溶液中加入烧碱溶液:HCO
|
下列叙述不正确的是( )
| A、根据能量守定律可知,反应物的总能量等于生成物的总能量 |
| B、酸碱中和反应是放热的 |
| C、氢氧化钡晶体与氯化铵固体反应是吸热的 |
| D、化学能可以转化为热能、电能、光能等 |
判断溶液的酸碱性有多种方法.下列溶液中,一定呈碱性的是( )
| A、能够使甲基橙呈现黄色 |
| B、溶液的pH>7 |
| C、溶液中:c(H+)<c(OH-) |
| D、溶液中:c(H+)>1×10-7mol?L-1 |
 下表是长式周期表的一部分,其中的编号代表对应的元素.
下表是长式周期表的一部分,其中的编号代表对应的元素.