题目内容
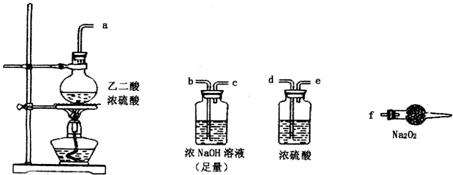
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通人SO2气体,将带余烬的木条插入试管C中,木条复燃。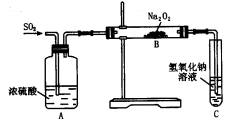
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是;
________。
(2)请设计一种实验方案证明Na2O2。与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
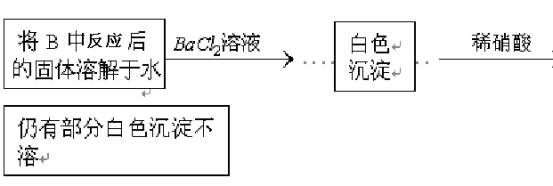
上述方案是否合理?________。请简要说明两点理由:①________;②________。
答案:
解析:
解析:
| 解析:(1)认为Na2O2与SO2反应生成了Na2SO3和O2,这是简单迁移了CO2与Ha2O2反应生成Na2CO3和O2的知识。
(2)运用SO2具有漂白性,能使品红褪色的知识。 (3)具体考虑到Na2O2有强氧化性及SO2有还原性,它们之间会发生氧化还原反应而生成Na2SO4,但他们设计的方案中仍然没有想到稀硝酸有强氧化性也能将亚硫酸根氧化为硫酸根,同样Ha2O2溶于水之后的物质也能把亚硫酸根氧化为硫酸根。 答案:(1)2Na2O2+2SO2=2Na2SO3+O2 (2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体 (3)不合理 ①稀硝酸能将亚硫酸钡氧化为硫酸钡 ②如果反应后的固体中还残留Ha2O2,它溶于水后能将亚硫酸根氧化成硫酸根
|

练习册系列答案
相关题目
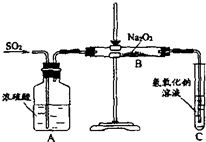
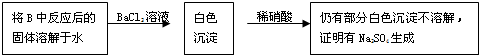


 有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:

 0
0