题目内容
叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质,3molNaN3受撞击会生成4mol氮气和离子化合物(Na3N).下列有关叙述错误的是
- A.NaN3受撞击时,既是氧化剂又是还原剂
- B.NaN3属于有机化合物
- C.Na3N中N3-半径比Na+半径大
- D.NaN3中,既存在离子键又存在非极性共价键
B
分析:A、根据氧化剂和还原剂的概念来判断;
B、有机化合物是含有碳原子的化合物;
C、核外电子数相等的微粒,则质子数越多半径越小;
D、氮化钠中钠离子和氮离子之间是离子键,氮原子之间是非极性共价键.
解答:3molNaN3受撞击会生成4mol氮气和离子化合物(Na3N)的方程式为:3NaN3 4N2↑+Na3N.
4N2↑+Na3N.
A、反应中氮元素的化合价既升高又降低,所以NaN3既是氧化剂又是还原剂,故A正确;
B、有机化合物是含有碳原子的化合物,氮化钠不是有机物,故B错误;
C、N3-和Na+具有相同的核外电子数,质子数越多半径越小,所以半径N3->Na+,故C正确;
D、氮化钠中钠离子和氮离子之间是离子键,氮原子之间是非极性共价键,故D正确.
故选B.
点评:本题主要考查学生氧化还原反应中的概念、有机物的概念以及微粒半径大小比较等方面的知识,难度不大.
分析:A、根据氧化剂和还原剂的概念来判断;
B、有机化合物是含有碳原子的化合物;
C、核外电子数相等的微粒,则质子数越多半径越小;
D、氮化钠中钠离子和氮离子之间是离子键,氮原子之间是非极性共价键.
解答:3molNaN3受撞击会生成4mol氮气和离子化合物(Na3N)的方程式为:3NaN3
 4N2↑+Na3N.
4N2↑+Na3N.A、反应中氮元素的化合价既升高又降低,所以NaN3既是氧化剂又是还原剂,故A正确;
B、有机化合物是含有碳原子的化合物,氮化钠不是有机物,故B错误;
C、N3-和Na+具有相同的核外电子数,质子数越多半径越小,所以半径N3->Na+,故C正确;
D、氮化钠中钠离子和氮离子之间是离子键,氮原子之间是非极性共价键,故D正确.
故选B.
点评:本题主要考查学生氧化还原反应中的概念、有机物的概念以及微粒半径大小比较等方面的知识,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一.下列有关说法正确的是( )
| A、NaN3中只含有离子键 | B、1molNaN3完全分解最多可以产生33.6LN2 | C、NaN3快速分解时,NaN3既是氧化剂,又是还原剂 | D、常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
 (2013?江苏三模)在5-氨基四唑(
(2013?江苏三模)在5-氨基四唑(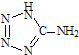 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.