题目内容
【题目】二氧化碳资源化利用是目前研究的热点之一。
(1)二氧化碳可用于重整天然气制合成气(CO和H2)。
①已知下列热化学方程式:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g)
CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H 2=-165kJ/mol,
CH4(g)+2H2O(g) △H 2=-165kJ/mol,
则反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=____kJ/mol。
2CO(g)+2H2(g)的△H=____kJ/mol。
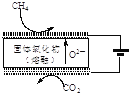
②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为________。
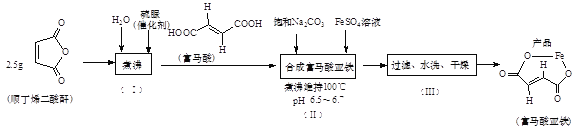
(2)由二氧化碳合成VCB(锂电池电解质的添加剂)的实验流程如下,已知EC、VCB核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
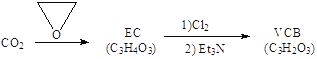
VCB的结构简式为_________。
(3)乙烷直接热解脱氢和CO2氧化乙烷脱氢的相关化学方程式及平衡转化率与温度的关系如下:
(I)乙烷直接热解脱氢:C2H6(g)![]() C2H4(g)+H2(g) △H1
C2H4(g)+H2(g) △H1
(Ⅱ)CO2氧化乙烷脱氢:C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g) △H2
C2H4(g)+CO(g)+H2O(g) △H2
①反应(I)的△H1= ____kJ/mol(填数值,相关键能数据如下表)。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 347.7 | 615 | 413.4 | 436.0 |
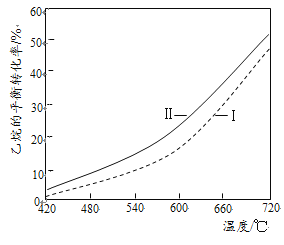
②反应(Ⅱ)乙烷平衡转化率比反应(I)的大,其原因是______(从平衡移动角度说明)。
③有学者研究纳米Cr2O3催化CO2氧化乙烷脱氢,通过XPS测定催化剂表面仅存在Cr6+和Cr3+,从而说明催化反应历程为:C2H6(g)→C2H4(g)+H2(g),______和_______(用方程式表示,不必注明反应条件)。
④在三个容积相同的恒容密闭容器中,温度及起始时投料如下表所示,三个容器均只发生反应:C2H6(g)img src="https://thumb.zyjl.cn/questionBank/Upload/2019/10/07/08/dcc46cb6/SYS201910070801057716573811_ST/SYS201910070801057716573811_ST.001.png" width="33" height="10" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />C2H4(g)+H2(g)。温度及投料方式(如下表所示),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 1molC2H6 | 2molC2H4+2molH2 | 1molC2H6 |
平衡时v正(C2H4)/ mol/(L·s) | v1 | v2 | v3 |
平衡时c(C2H4)/ mol/L | c1 | c2 | c3 |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是_______(填标号)。
A.K1=K2,v1<v2 B.K1<K3,v1< v3 C.v2>v3,c2>2c3 D.c2+c3<3c1
【答案】+247 CH4+O2--2e-=CO+2H2  +123.5 反应Ⅱ相当于反应Ⅰ中乙烷热解的产物H2,与CO2进一步发生反应:CO2+H2
+123.5 反应Ⅱ相当于反应Ⅰ中乙烷热解的产物H2,与CO2进一步发生反应:CO2+H2![]() CO+H2O,降低了反应Ⅰ中生成物H2的浓度,使平衡向生成乙烯的方向移动 3CO2+Cr2O3=2CrO3+3CO 2CrO3+3H2=Cr2O3+3H2O AD
CO+H2O,降低了反应Ⅰ中生成物H2的浓度,使平衡向生成乙烯的方向移动 3CO2+Cr2O3=2CrO3+3CO 2CrO3+3H2=Cr2O3+3H2O AD
【解析】
(1)根据盖斯定律,将已知的两个热化学方程式叠加,可得待求反应的热化学方程式;
②电解时,阳极CH4发生氧化反应变为CO;阴极上CO2被还原为CO;
(2)根据EC、VCB核磁共振氢谱均只有一组峰,结合二者的分子式及均含五元环状结构,EC能水解生成乙二醇确定物质结构;
(3)(I)根据反应热为断裂反应物化学键吸收的能量与形成生成物化学键释放的能量差计算反应热;
②(Ⅱ)根据两个反应产生的物质的区别分析;
③根据题干信息及已知的方程式书写待求的反应方程式;
④根据①可知反应C2H6(g)![]() C2H4(g)+H2(g)的正反应是吸热反应,化学平衡常数只与温度有关,利用温度、浓度对化学反应速率和平衡移动的影响分析。
C2H4(g)+H2(g)的正反应是吸热反应,化学平衡常数只与温度有关,利用温度、浓度对化学反应速率和平衡移动的影响分析。
(1)①a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=206kJ/mol,
CO(g)+3H2(g) △H1=206kJ/mol,
b.CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H2=-165 kJ/mol,
CH4(g)+2H2O(g) △H2=-165 kJ/mol,
根据盖斯定律,将a×2+b,整理,可得反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=+247kJ/mol。
2CO(g)+2H2(g)的△H=+247kJ/mol。
②根据图示可知:在阳极CH4失去电子,被氧化产生CO,电极反应式为:CH4+O2--2e-=CO+2H2;
(2)EC、VCB核磁共振氢谱均只有一组峰,均含五元环状结构,结合二者的分子式及EC能水解生成乙二醇确定物质结构,可知EC为 ,VCB为
,VCB为 ;
;
(3)(I)C2H6(g)![]() C2H4(g)+H2(g) 的反应热△H1=6C—H+C—C-4C—H-H—H-C=C=(2×413.4+347.7-615-436.0)kJ/mol=+123.5 kJ/mol;
C2H4(g)+H2(g) 的反应热△H1=6C—H+C—C-4C—H-H—H-C=C=(2×413.4+347.7-615-436.0)kJ/mol=+123.5 kJ/mol;
(II)根据反应方程式可知:反应Ⅱ相当于反应Ⅰ中乙烷热解的产物H2,与CO2进一步发生反应:CO2+H2![]() CO+H2O,降低了反应Ⅰ中生成物H2的浓度,减小生成物的浓度,化学平衡正向移动,使平衡向生成乙烯的方向移动,从而提高了原料的转化率;
CO+H2O,降低了反应Ⅰ中生成物H2的浓度,减小生成物的浓度,化学平衡正向移动,使平衡向生成乙烯的方向移动,从而提高了原料的转化率;
③有学者研究纳米Cr2O3催化CO2氧化乙烷脱氢,通过XPS测定催化剂表面仅存在Cr6+和Cr3+,由于催化剂参加反应,在反应过程中被CO2氧化为+6价的CrO3,反应前后质量不变,则催化反应历程为:C2H6(g)→C2H4(g)+H2(g),3CO2+Cr2O3=2CrO3+3CO和2CrO3+3H2=Cr2O3+3H2O;
④A.化学平衡常数只与温度有关,温度相同,化学平衡常数相同,所以K1=K2;将容器1与容器2对比,容器2反应相当于容器1反应达到平衡后将容器的容积减小一半,增大压强,物质浓度增大,化学反应速率加快,所以v1<v2,A正确;
B.容器1与容器3对比,相当于降低温度,降低温度,化学平衡向放热的逆反应方向移动,化学平衡常数减小,K3<K1;降低温度,反应速率降低,所以v1>v3,B错误;
C.容器2对于容器3来说,温度升高,反应物的物质浓度大,所以反应速率v2>v3;容器2对于容器1来说,相当于压强是容器1的二倍,增大压强,平衡逆向移动,所以c2<2c1;容器3相当对于容器1来说,相当于降低了容器的温度,降低温度,平衡逆向移动,所以c3<c1,因此c2、c3的关系可能c2<2c3,也可能c2>2c3,C错误;
D.根据选项C分析可知c2<2c1,c3<c1,所以c2+c3<3c1,D正确;
故合理选项是AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案