题目内容
10.如图是铜锌原电池装置,下列有关叙述错误的是( )
| A. | 负极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+2H+═Zn2++H2↑ | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向CuSO4溶液 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,阳离子移向正极,以此解答该题.
解答 解:A.锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,故A正确;
B.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B错误;
C.电子从电池负极经外电路流向正极,故C正确;
D.K+移向正极CuSO4溶液,故D正确.
故选B.
点评 本题考查原电池的工作原理,注意把握工作原理以及电极方程式的书写,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 全部由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 只有在双原子单质分子中,相同的非金属原子之间才能形成化学键 | |
| D. | 两个非金属原子间可能形成离子键 |
18.X、Y、Z、W均为短周期元素,X、Y同主族,X的氢化物和其最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、Y是第三周期连续的三种元素,其中只有一种是金属元素.下列叙述正确的是( )
| A. | X、Y两元素最简单氢化物的稳定性:X<Y | |
| B. | Z、W的氧化物均能与稀硫酸反应 | |
| C. | Z和W的氧化物均可作耐高温材料 | |
| D. | W的单质可用于制备光导纤维 |
15.下列有机化合物的分类不正确的是( )
| A. |  苯的同系物 | B. |  芳香化合物 | C. |  烯烃 | D. |  醇 |
19.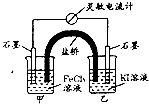 控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
 控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )| A. | 盐桥中的K+移向FeCl3溶液 | |
| B. | 反应开始时,乙中石墨电极上发生氧化反应 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电级为负极 |
20.下列关于如图所示原电池装置的叙述中,正确的是( )


| A. | 每当Zn片质量减少65克,Cu片会产生22.4L气体 | |
| B. | 溶液的pH逐渐减小 | |
| C. | 电子从锌片经导线流向铜片 | |
| D. | 氢离子在铜片表面被氧化 |




