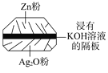
��Ŀ����
����Ŀ����������(Na2FeO4)���к�ǿ�������ԣ���һ�����͵���ɫ��ˮ����������ҵ����������(��Ҫ�ɷ���FeCO3������SiO2)Ϊԭ���Ʊ��������Ƶ�����������ͼ��

��֪��Na2FeO4���ڼ��Ի������ȶ����ڡ�
��ش��������⣺
��1��Na2FeO4����Ԫ�صĻ��ϼ�Ϊ__�����б�־��Ӧ����ʢװNa2FeO4�����ϵ���__��

��2������������Ŀ����__��д���������������SiO2��������Ӧ�Ļ�ѧ����ʽΪ__��
��3������1�����2��ʵ�����ƾ�Ϊ____������۵�Ŀ���ǽ�Fe2��������Fe3���������ӷ���ʽΪ___��
��4����������������Ļ�ԭ������о�ˮ���ã����;�ˮԭ��Ϊ__��
��5����֪4FeO42����10H2O![]() 4Fe(OH)3��8OH����3O2������һ������Na2FeO4Ͷ�뵽pH��ͬ�Ĺ�ҵ��ˮ��(��ˮ������ɷ־���ͬ)�������Һ��Na2FeO4Ũ�ȱ仯��ͼ���ߢ���ʾ���Է������ߢ�����ߢ��Ӧ����ˮpH__(����������������)��
4Fe(OH)3��8OH����3O2������һ������Na2FeO4Ͷ�뵽pH��ͬ�Ĺ�ҵ��ˮ��(��ˮ������ɷ־���ͬ)�������Һ��Na2FeO4Ũ�ȱ仯��ͼ���ߢ���ʾ���Է������ߢ�����ߢ��Ӧ����ˮpH__(����������������)��

���𰸡�+6�ۣ� d�� ����Ӧ�ĽӴ�������ӿ컯ѧ��Ӧ���ʣ� SiO2+2NaOH=NaSiO3+H2O�� ���ˣ� 2Fe2++ ClO-+2H+=2Fe3++Cl- + H2O�� ���ɵ����������ӿ��Է���ˮ�����������������壬����������������������ã���������ˮ���� �ߣ�
��������
������������Ҫ�ɷ���FeCO3������SiO2��������NaOH��Һ���ܣ�SiO2��NaOH��Ӧ�õ���������Һ�����ˣ�������Ҫ����FeCO3������ϡ�����ܽ⣬�õ�Fe2+��������Һ������NaClO��Һ����Fe2+��2Fe2++ClO-+2H+=2Fe3++Cl-+H2O���ټ���NaOH��NaClO��Һ��������Fe3+����ӦΪ��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O����õ���Na2FeO4��Һ�м��������������ƹ���õ�����Һ�����˵õ��������ơ�
��1��Na2FeO4����Ԫ�صĻ��ϼ�Ϊ+6�ۣ�����������м�ǿ�������ԣ�����Ӧ�����������ı�ǩ��
��2������������Ŀ��������Ӧ�ĽӴ�������ӿ컯ѧ��Ӧ���ʣ�д���������������SiO2���������Ʒ�Ӧ����Ӧ�Ļ�ѧ��Ӧ����ʽΪ��SiO2+2NaOH=NaSiO3+H2O��
��3������1�����2��ʵ�����ƾ�Ϊ���ˣ��������Fe2���ʹ������Ʒ�Ӧ����Fe3�������ӷ���ʽΪ��2Fe2++ ClO-+2H+=2Fe3++Cl- + H2O��
��4����������������Ļ�ԭ���������������ӣ����������ӿ��Է���ˮ�ⷴӦ��Fe3++3H2O![]() Fe��OH��3�����壩+3H+�����ɾ��������Ե������������壬����Ҳ���Ծ�ˮ��
Fe��OH��3�����壩+3H+�����ɾ��������Ե������������壬����Ҳ���Ծ�ˮ��
��5�����ݷ�Ӧ����ʽ�в������������жϵ���ҺΪ����ʱ�����Ƹ������ˮ�⣬ʹƽ���������ƶ������������Ũ�Ƚϴ����Խ��ͼ������PH������