题目内容
6.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下22.4LNH3中含有的分子总数小于NA | |
| B. | 1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA | |
| C. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA | |
| D. | 0.1 mol/L的醋酸钠溶液中含CH3COOH、CH3COO- 粒子总数为0.1 NA |
分析 A、常温常压下的气体摩尔体积大于22.4L/mol;
B、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体;
C、氯气与氢氧化钠的反应为歧化反应;
D、溶液体积不明确.
解答 解:A、常温常压下的气体摩尔体积大于22.4L/mol,故常温常压下的22.4L氨气的物质的量小于1mol,故分子个数小于NA个,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故1mol三价铁离子水解得到的氢氧化铁胶粒的个数小于NA个,故B错误;
C、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子即NA个,故C错误;
D、溶液体积不明确,故溶液中的CH3COOH、CH3COO- 粒子总数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.现有NO、NO2、O3三种气体,它们都含有1mol氧原子,则三种气体的物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
12.下列各组离子在常温下一定能大量共存的是( )
| A. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 在c(H+)/C(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
14.下列四个数据是不同条件下测出的合成氨的反应的速率,其中最慢的是( )
| A. | v(NH3)=0.15 mol/L•min | B. | v(H2)=0.1 mol/L•min | ||
| C. | v(N2)=0.1 mol/L•min | D. | v(N2)=0.002 mol/L•s |
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列说法正确的是( )
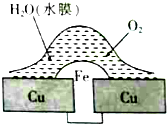

| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
15.通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一.下列由实验现象得出正确结论的是( )
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下不一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 工业上常用电解法电解熔融的DE3制备元素D的单质 |
 ;
; .
. .
. 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题: