题目内容
4.为了确定某样品是否被氧化,所选试剂(括号内物质)不正确的是( )| A. | FeCl2(NH4SCN溶液) | B. | KI(淀粉溶液) | ||
| C. | 白磷(紫色石蕊试液) | D. | Na2SO3( BaCl2 溶液) |
分析 A.亚铁离子易被氧化为铁离子;
B.碘离子能被氧化为碘单质;
C.白磷被氧化为五氧化二磷,遇水反应生成磷酸;
D.亚硫根离子能被氧化为硫酸根离子,都能与钡离子反应生成沉淀.
解答 解:A.亚铁离子易被氧化为铁离子,可利用NH4SCN溶液检验铁离子,若溶液为血红色来确定样品被氧化,故A正确;
B.碘离子能被氧化为碘单质,淀粉遇碘变蓝,则可利用淀粉溶液来确定样品被氧化,故B正确;
C.白磷被氧化为五氧化二磷,遇水反应生成磷酸,加紫色石蕊溶液变红,则可以确定样品被氧化,故C正确;
D.亚硫根离子能被氧化为硫酸根离子,都能与钡离子反应生成沉淀,则不能确定样品被氧化,故D错误;
故选D.
点评 本题考查物质检验及氧化还原反应,为高频考点,把握物质的性质、离子检验及发生的反应为解答的关键,侧重分析与应用能力的考查,注意变质混有的离子的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.分子式为C4H10O的醇与C5H10O2的羧酸和浓H2SO4存在时共热生成的酯有( )
| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |
17.化学与生活、社会密切相关,下列说法正确的是( )
| A. | 食品添加剂对人体的健康均无害,所以不用严格控制用量 | |
| B. | 棉、麻、丝、毛的主要成分都是纤维素 | |
| C. | 光纤的主要成分是二氧化硅 | |
| D. | 农业施肥所用的碳铵和尿素均属于无机物 |
19.下列实验装置设计正确的是( )
| A. | 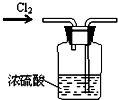 干燥氯气 | B. |  稀释浓硫酸 | ||
| C. |  实验室制氨气 | D. | 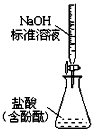 测定盐酸浓度 |
9.图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃性气体,C是A、B的混合气体,则C中n(A):n(B) 为( )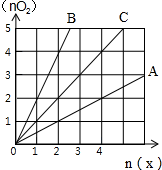
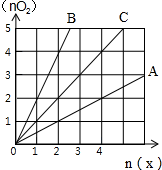
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意 |
16.有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+ | |
| B. | 肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- | |
| C. | 肯定有K+、Al3+、MnO4-,可能有HCO3- | |
| D. | 肯定有Al3+、Mg2+、Cl-,可能有K+ |
14.柠檬烯是一种食用香精,其结构简式为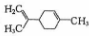 ,有关柠檬烯的分析正确的是( )
,有关柠檬烯的分析正确的是( )
 ,有关柠檬烯的分析正确的是( )
,有关柠檬烯的分析正确的是( )| A. | 一氯代物共有7种 | |
| B. | 分子中所有碳原子一定在同一平面 | |
| C. | 和丁基苯(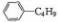 )互为同分异构体 )互为同分异构体 | |
| D. | 一定条件下,分别可以发生加成、取代、氧化反应 |
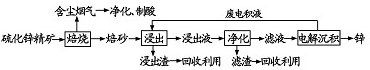
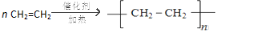 .
.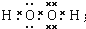 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式. .与PH3相比,DC2易液化的主要原因是NH3中有氢键;
.与PH3相比,DC2易液化的主要原因是NH3中有氢键;