题目内容
【题目】传统接触法制取硫酸能耗大,污染严重。将燃料电池引入硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如图所示。
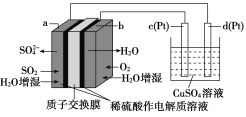
下列说法不正确的是( )
A.b为正极,电极反应式为O2+4H++4e-===2H2O
B.H+由a极通过质子交换膜向b极移动
C.该燃料电池的总反应为2SO2+O2+2H2O===2H2SO4
D.若a电极消耗标况下2.24 L SO2,理论上在c极上有6.4 g铜析出
【答案】D
【解析】
A.b为正极,看到质子交换膜确定酸性环境,电极反应式为O2+4H++4e-=2H2O,故A正确;
B.原电池内部阳离子向正极移动,阴离子向负极移动,故B正确;
C.分析图中信息可知该燃料电池的总反应为2SO2+O2+2H2O=2H2SO4,故C正确;
D.d极与电源负极相连,为阴极得电子,有铜析出,所以应该是若a电极消耗标况下2.24 L SO2,理论上在d极上有6.4 g铜析出,故D不正确。
故答案选D。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目