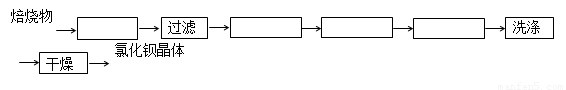题目内容
用38%的浓盐酸(密度1.19g·mL-1)配制1:4的稀盐酸。
(1)求所得稀盐酸(ρ=1.04g·mL-1)的物质的量浓度。
(2)如果用所得盐酸来配制0.1mol·L-1的盐酸溶液500mL,问应该怎样配制?
答案:
解析:
解析:
(1)2.48mol·L-1 用1L盐酸与4LH2O混合所得稀盐酸的总质量为(1000×1.19)+4000=5190g。 c(HCl)= (2)设稀盐酸浓度为c1,所需体积为V1则根据c1V1=c2V2,得2.48V1=0.1×0.5,V1=0.02L=20mL。 配法:量取20mL稀盐酸,慢慢加入盛有少量蒸馏水的烧杯中,然后沿玻璃棒转移至500mL容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也转移到容量瓶中。加水距刻度线1-2cm处,改用胶头滴管逐滴加入,使液体凹液面与刻度线相切,塞紧瓶塞摇匀,转入试剂瓶,贴上标签。
|

练习册系列答案
相关题目
 =2.48 mol·L-1
=2.48 mol·L-1 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。