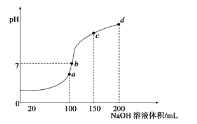
题目内容
【题目】(1)某二元酸(化学式用H2A表示)在水中的电离方程式是H2A═H++HA-,HA-![]() H++A2-;试完成下列问题:
H++A2-;试完成下列问题:
NaHA溶液显__(填“酸性”、“中性”或“碱性”),Na2A溶液显__(填“酸性”、“中性”或“碱性”)。理由是__(用离子方程式表示)。
(2)pH=5的NH4Cl溶液与pH=5的HCl溶液中由水电离出的c(H+)分别是__、__。
【答案】碱性 碱性 A2-+H2O![]() HA-+OH- 10-5mol·L-1 10-9mol·L-1
HA-+OH- 10-5mol·L-1 10-9mol·L-1
【解析】
(1)依据H2A═H++HA-,HA-![]() H++A2-判断,此二元酸的第一步电离是完全的,即HA-不水解;
H++A2-判断,此二元酸的第一步电离是完全的,即HA-不水解;
(2)NH4Cl为强酸弱碱盐,促进水的电离,HCl为强酸,抑制水的电离;
(1)依据H2A═H++HA-,HA-![]() H++A2-判断,此二元酸的第一步电离是完全的,即HA-不水解,但是HA-存在电离:HA-
H++A2-判断,此二元酸的第一步电离是完全的,即HA-不水解,但是HA-存在电离:HA-![]() H++A2-,故NaHA溶液显酸性;Na2A溶液中A2-能发生水解反应,A2-+H2O HA-+OH-,溶液显碱性;
H++A2-,故NaHA溶液显酸性;Na2A溶液中A2-能发生水解反应,A2-+H2O HA-+OH-,溶液显碱性;
(2)NH4Cl为强酸弱碱盐,促进水的电离,则溶液中的氢离子由水提供,即水电离出的c(H+)=10-5mol/L,HCl为强酸,抑制水的电离,根据离子积常数,水电离出的氢离子浓度与氢氧根离子浓度相同,则c(H+)=c(OH-)= ![]() =10-9mol/L。
=10-9mol/L。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目