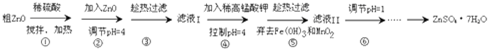
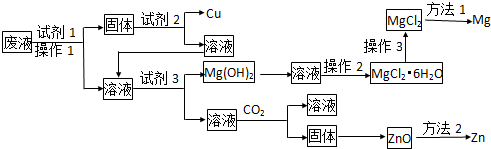
题目内容
14.下列有关物质性质的比较顺序中,不正确的是( )| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 还原性:Al>Mg>Na |
分析 A、非金属性越强氢化物的稳定性越强,同主族自上而下元素的非金属性减弱;
B、电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C、非金属性越强最高价氧化物对应水化物的酸性越强,同周期自左而右元素的非金属性增强;
D、同周期从左到右元素的金属性减弱,金属单质的还原性减弱.
解答 解:A、同主族自上而下元素的非金属性减弱,故非金属性F>Cl>Br>I,所以氢化物稳定性HF>HCl>HBr>HI,故A正确;
B、电子层结构相同核电荷数越大离子半径越小,故离子半径Na+>Mg2+,最外层电子数相同电子层越多离子半径越大,所以微粒半径K+>Na+,故微粒半径K+>Na+>Mg2+,故B正确;
C、同周期自左而右元素的非金属性增强,故非金属性P<S<Cl,所以酸性HClO4>H2SO4>H3PO4,故C正确;
D、同周期从左到右元素的金属性减弱,金属单质的还原性减弱,故还原性Al<Mg<Na,故D错误;
故选D.
点评 本题考查微粒半径比较、同周期同主族元素的性质递变规律等,难度中等,注意掌握微粒半径大小比较规律与金属性、非金属性的比较.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2. 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g.
常用物理常数:
请根据以上信息回答下列问题:
(1)仪器A的名称是球形冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)实验中加入甲苯对合成水杨酸甲酯的作用是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)反应结束后,分离甲醇的操作是蒸馏(或水洗分液).
(4)洗涤操作中,第一次水洗的主要目的是洗掉大部分的硫酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(5)检验产品中是否含有水杨酸的化学方法是向产品中滴加少量的紫色石蕊试液,观察是否变红.
(6)本实验的产率为59%(保留两位有效数字).
 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)实验中加入甲苯对合成水杨酸甲酯的作用是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)反应结束后,分离甲醇的操作是蒸馏(或水洗分液).
(4)洗涤操作中,第一次水洗的主要目的是洗掉大部分的硫酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(5)检验产品中是否含有水杨酸的化学方法是向产品中滴加少量的紫色石蕊试液,观察是否变红.
(6)本实验的产率为59%(保留两位有效数字).
9.下列各组物质的燃烧热相等的是( )
| A. | C和CO | B. | 红磷和白磷 | ||
| C. | 3molC2H2(乙炔)和1molC6H6(苯) | D. | 1gH2和2gH2 |
19.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)?C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )
①混合气体的密度不再变化时
②容器内气体的压强不再变化时
③混合气体的总物质的量不再变化时
④B的物质的量浓度不再变化时
⑤混合气体的平均相对分子质量不再改变的状态
⑥当V正(B)=2V逆(C)
①混合气体的密度不再变化时
②容器内气体的压强不再变化时
③混合气体的总物质的量不再变化时
④B的物质的量浓度不再变化时
⑤混合气体的平均相对分子质量不再改变的状态
⑥当V正(B)=2V逆(C)
| A. | ①④⑤⑥ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | 只有④ |
6.有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素 原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
(1)五种元素的名称:A氧,C硫,E铝.
(2)画出A离子的结构示意图: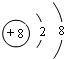
(3)B、C、D元素的原子半径由小到大的顺序为P>S>Cl(用元素符号表示),它们的最高价氧化物对应水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4(用对应的酸表示)
(4)A与E形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物.
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O.
| A | ||
| B | C | D |
(2)画出A离子的结构示意图:
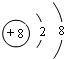
(3)B、C、D元素的原子半径由小到大的顺序为P>S>Cl(用元素符号表示),它们的最高价氧化物对应水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4(用对应的酸表示)
(4)A与E形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物.
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O.
3.将3.48g四氧化三铁完全溶解在100mL 1mol•L-1 的硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
| A. | 0.05mol•L-1 | B. | 0.1mol•L-1 | C. | 0.2mol•L-1 | D. | 0.3mol•L-1 |
4.等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加的是( )
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |