题目内容
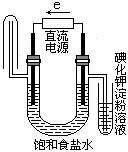
下图中能验证氯化钠溶液(含酚酞)电解产物的装置是
- A.

- B.

- C.

- D.

分析:惰性电极电解食盐水的生成物是氢气、氢氧化钠和氯气.其中氢气在阴极产生,且氢气的密度小于空气的用向下排空气法收集.而氯气在阳极产生,且具有强氧化性,能把碘化钾氧化生成单质碘,碘于淀粉显蓝色,以此解答该题.
解答:先判断电解池的阴、阳极,电子从直流电源负极流向电解池阴极,则左端为阴极.电解饱和食盐水时,阳极的电极反应式为2Cl-→Cl2↑+2e-,用KI淀粉溶液检验产生的Cl2;阴极的电极反应式为2H++2e-→H2↑,阴极有H2生成.结合图示,左端用向下排空气法收集H2,为阴极.B项不能检验是否生成Cl2.
故选D.
点评:该题是基础性试题的考查,也是高考中的常见题型,属于中等难度的试题.试题贴近高考,灵活性强.有利于培养学生灵活运用基础知识解决实际问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
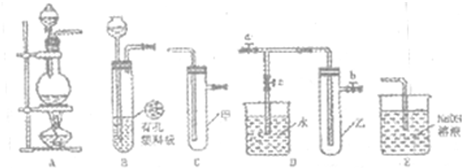
小学生10分钟应用题系列答案(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹)。

(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接: → → (填字母编号)。
②选择所需的试剂: (填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论: 。
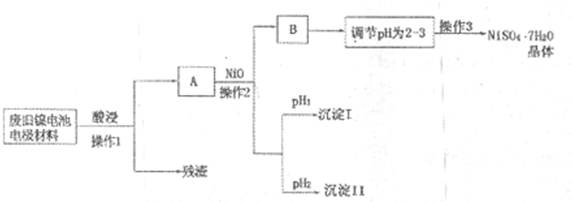
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:

已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
|
M(OH)n |
Ksp[来源:学_科_网][来源:学#科#网Z#X#X#K] |
pH |
|
|
开始沉淀 |
沉淀完全 |
||
|
Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
|
Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
|
Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是 沉淀II是 (填化学式),pH1 pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(3)“调节pH为2-3”的目的是 ;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是 。
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹).

(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱.
①选择合理的装置连接:______→______→______(填字母编号).
②选择所需的试剂:______(填字母编号).
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:______.
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4?7H2O晶体,设计实验流程如下:

已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(1)根据上表数据判断操作2依次析出的沉淀I是______沉淀II是______(填化学式),pH1______pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为______.
(3)“调节pH为2-3”的目的是______;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是______.









 B、
B、
 D、
D、