题目内容
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则K2=_______ (用含K1、K3、K4的代数式表示)
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
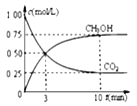
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
【答案】 K1/K3K4 A、C 33.33/P2 正向
【解析】(1)根据平衡常数的表达式可知K1=c(CH3OH)/c(CO)c2(H2);K2= c(CH3OH )/c(CO2)c3(H2); K3= c(CO2)c(H2)/c(CO)c(H2O); K4= c(H2O);通过以上整理可得:K2= K1/K4K3;正确答案:K1/K3K4。
(2) 该反应反应前后气体总质量不变,气体总量为减小的可逆反应,所以当混合气体平均相对分子质量不变时,反应达到平衡状态;A正确;该反应反应前后气体总质量不变,恒容密闭容器中,混合气体密度恒为定值,不能判定反应是否达到平衡状态;B错误;该反应为气体总量减小的反应,其他条件下不变,压强和气体的物质的量成正比,当容器内压强恒定不变,反应达到平衡状态;C正确;速率之比和系数成正比,3V(CO2)=V(H2),满足3V正(CO2)=V逆(H2)反应达到平衡状态,D错误;CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1为反应的一种特殊情况,不能判定反应是否达平衡状态,E错误;单位时间内断裂3NAH-H键,是正向速率,同时形成2molH-O键,也是正向速率,不能判定反应达到平衡状态;F错误;正确选项A、C 。
②根据图像可知:容器的体积为1L,根据方程式进行如下计算:
CO2(g) 十 3H2(g) CH3OH(g) 十 H2O(g)
起始量 1 3 0 0
变化量 0.75 2.25 0.75 0.75
平衡量 0.25 0.75 0.75 0.75
平衡分压 0.1P 0.3 P 0.3 P 0.3 P
所以化学平衡常数KP为P(CH3OH)×P(H2O)/P(CO2)×P3(H2) ;P(CH3OH)×P(H2O)=0.3 P×0.3 P=0.09 P2 ,P(CO2)×P3(H2)=0.1 P×(0.3 P)3=0.0027 P4;KP为0.09 P2/0.0027 P4=33.33/P2;若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则浓度商Qp= P(CH3OH)×P(H2O)/ P(CO2)×P3(H2);这时,各物质分压分别为:P(CH3OH)=1/3 P, P(H2O)=0.25 P, P(CO2)=1/6 P, P(H2)=0.25 P;把数据带入Qp=32/p2<33.33/P2=KP,所以平衡正向移动;正确答案:33.33/P2 ;正向。

【题目】下表所示的体检报告的部分项目中,表示总胆固醇指标的物理量是( )
送检物:血液 检验目的:血常规 血型:O型 | 检验结果: 项目中文名称结果单位参考值 ALT谷丙转氨酶7U/L<40 ALB白蛋白43.9g/L35-55 TC总胆固醇4.27mmol/L3.6-5.18 |
A.溶解度B.质量分数C.密度D.物质的量浓度