题目内容
某碱溶液的pH=13,此碱溶液的物质的量浓度( )
| A、0.1 mol?L-1. |
| B、一定大于0.1 mol?L-1 |
| C、若为强碱一定等于0.1 mol?L-1,若为弱碱一定大于0.1 mol?L-1 |
| D、若为强碱一定≤0.1 mol?L-1,若为弱碱一定>0.1 mol?L-1 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:根据pH=13,说明氢离子浓度为10-13mol/L,根据Kw=c(H+)×c(OH-),求出氢氧根离子浓度,氢氧根离子浓度取决于碱的浓度以及强弱,据此分析解答.
解答:
解:某碱溶液的pH=13,c(H+)=1×10-13mol/L,Kw=c(H+)×c(OH-),c(OH-)=
=0.1mol/L.
A.碱未知其为一元、二元、多元碱、且未知其为强碱、弱碱,所以无法判断碱的浓度,故A错误;
B.当碱为一元强碱,此碱溶液的物质的量浓度等于0.1 mol?L-1,故B错误;
C.若为强碱且须为一元强碱,其浓度一定等于0.1 mol?L-1,否则不是,若为弱碱一定不为一元弱碱才满足大于0.1 mol?L-1,否则不是,故C错误;
D.若为强碱一元时一定=0.1 mol?L-1,多元时,一定<0.1 mol?L-1,若为弱碱,弱碱部分电离,一元弱碱一定>0.1 mol?L-1,故D正确;
故选D.
| 1×10-14 |
| 1×10-13 |
A.碱未知其为一元、二元、多元碱、且未知其为强碱、弱碱,所以无法判断碱的浓度,故A错误;
B.当碱为一元强碱,此碱溶液的物质的量浓度等于0.1 mol?L-1,故B错误;
C.若为强碱且须为一元强碱,其浓度一定等于0.1 mol?L-1,否则不是,若为弱碱一定不为一元弱碱才满足大于0.1 mol?L-1,否则不是,故C错误;
D.若为强碱一元时一定=0.1 mol?L-1,多元时,一定<0.1 mol?L-1,若为弱碱,弱碱部分电离,一元弱碱一定>0.1 mol?L-1,故D正确;
故选D.
点评:本题主要考查了氢氧根离子的浓度与碱的浓度关系,试题培养了学生的知识应用能力,题目难度不大,注意知识的积累.

练习册系列答案
相关题目
下列事实能说明苯环中不存在单双键交替的是( )
| A、苯不能使酸性KMnO4溶液褪色 |
| B、苯在一定条件下可与液溴发生取代反应 |
| C、苯在一定条件下可与H2发生加成反应 |
| D、苯不能使溴水褪色 |
氮气常用作保护气,其原因是( )
| A、氮气在任何条件下不与其他物质发生化学反应 |
| B、氮气比氧气稳定 |
| C、氮气是双原子分子 |
| D、氮气分子中的N≡N键很牢固 |
 在图中,曲线a表示一定条件下,可逆反应X(g)+Y(g)?2Z(g)+W(s)(正反应放热)的反应过程,若使b曲线变为a曲线,可采取的措施是( )
在图中,曲线a表示一定条件下,可逆反应X(g)+Y(g)?2Z(g)+W(s)(正反应放热)的反应过程,若使b曲线变为a曲线,可采取的措施是( )| A、加催化剂 |
| B、增大Y的浓度 |
| C、降低温度 |
| D、减小反应体系压强 |
下列说法或表示法正确的是( )
| A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
| C、C(石墨)=C(金刚石)△H>0 所以石墨比金刚石稳定 |
| D、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
有一种气体在标准状况下体积是4.48升,质量是14.2g,则该气体的摩尔质量是( )
| A、28.4 |
| B、28.4g?mol-1 |
| C、71 |
| D、71g?mol-1 |
下列说法正确的是( )
A、钾(K)原子基态的原子结构示意图为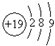 |
B、H2O电子式为 |
| C、Mg的原子基态电子排布式为1s22s22p63s23p1 |
| D、Ca原子基态电子排布式为1s22s22p63s23p6 |
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A、常温常压下,48g O3所含的氧原子数为 3NA |
| B、常温常压下,22.4 L氧气所含的原子数为 2NA |
| C、标准状况下,22.4L H2O含有的分子数为 NA |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
向体积为VaL浓度为0.05mol?L-1CH3COOH溶液中加入体积为Vb L浓度为0.05mol?L-1KOH溶液,下列关系错误的是( )
| A、Va>Vb时:c (CH3COOH)+c (CH3COO-)>c (K+) |
| B、Va=Vb时:c (CH3COOH)+c (H+)=c (OH-) |
| C、Va<Vb时:c (CH3COO-)>c (K+)>c (OH-)>c (H+) |
| D、Va与Vb任意比时:c (K+)+c (H+)=c (OH-)+c (CH3COO-) |