题目内容
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
现有反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(2) 已知在一定温度下:
C(s)+CO2(g) 2CO
2CO (g)平衡常数K1;
(g)平衡常数K1;
C(s)+H2O(g) CO(g)+H2(g)平衡常数K2;
CO(g)+H2(g)平衡常数K2;
CO(g)+H2O( g)
g) H2(g)+CO2(g)平衡常数K;
H2(g)+CO2(g)平衡常数K;
则K1、K2 、K之间的关系是___________。
(3)某催化反应室中发生的反应为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+216 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2
已知CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-44 kJ·mol-1,则ΔH2=_________。
(4)某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因 素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
①写出大试管中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
②实验结果表明,催化剂的催化效果与  有关。
有关。


 H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.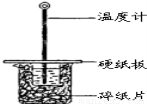
 、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是( ) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量), 则下列说法正确的是( )
则下列说法正确的是( )
 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )