题目内容
(2013?厦门二模)(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.
①M的原子结构示意图为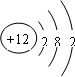
 .
.
②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为
(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺.
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为
A.H2O2溶液B.铜粉C.稀硫酸D.KMnO4溶液
(3)高铁酸钾在水中的反应为4Fe
+10H2O?4Fe(OH)3+8OH-+3O2
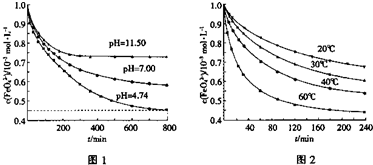
①图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况.pH=4.74时,反应从开 始到800min的平均反应速率v(FeO
)=
②图1在800min后,三种溶液中K2FeO4的浓度均不再改变.观察图1判断随着pH 变大,此反应的平衡常数
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,则上述反应的反应热△H
①M的原子结构示意图为


②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为
Al+4OH--3e-=[Al(OH)4]-
Al+4OH--3e-=[Al(OH)4]-
.(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺.
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
| ||
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为
BC
BC
(填序号)A.H2O2溶液B.铜粉C.稀硫酸D.KMnO4溶液
(3)高铁酸钾在水中的反应为4Fe
2- 4 |
①图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况.pH=4.74时,反应从开 始到800min的平均反应速率v(FeO
2- 4 |
6.9×10-7mol/L?min
6.9×10-7mol/L?min
(保留两位有效数字).②图1在800min后,三种溶液中K2FeO4的浓度均不再改变.观察图1判断随着pH 变大,此反应的平衡常数
不变
不变
(填“变大”、“变小”或“不变”).③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,则上述反应的反应热△H
>
>
0(填“>”、“<”、“=”).
分析:(1)①元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”,推断为镁;
②以Mg、Al为电极,KOH溶液为电解质溶液,则负极为Al;
(2)①水进行淬火是铁和水蒸气反应生成四氧化三铁和氢气;
②验证铁用水淬火后的固体产物是否存在+3价的铁,试剂需要用酸溶解固体,且不能把铁氧化,加入铜发生反应产生溶解现象;
(3)①分析图象计算离子的变化浓度,结合化学反应速率概念计算得到;
②平衡常数随温度变化,不随溶液酸碱性,离子浓度变化;
③图象分析可知温度升高,反应的FeO42-浓度增大,平衡正向进行.
②以Mg、Al为电极,KOH溶液为电解质溶液,则负极为Al;
(2)①水进行淬火是铁和水蒸气反应生成四氧化三铁和氢气;
②验证铁用水淬火后的固体产物是否存在+3价的铁,试剂需要用酸溶解固体,且不能把铁氧化,加入铜发生反应产生溶解现象;
(3)①分析图象计算离子的变化浓度,结合化学反应速率概念计算得到;
②平衡常数随温度变化,不随溶液酸碱性,离子浓度变化;
③图象分析可知温度升高,反应的FeO42-浓度增大,平衡正向进行.
解答:解:(1)①元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”,推断为镁,镁原子为12号元素,原子结构示意图为 ,
,
故答案为: ;
;
②以Mg、Al为电极,负极的电极反应式为:Al+4OH--3e-=[Al(OH)4]-,故答案为:Al+4OH--3e-=[Al(OH)4]-;
(2)①使用水进行淬火,若生成磁性氧化铁,反应的化学方程式是铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
Fe3O4+4H2,
故答案为:3Fe+4H2O
Fe3O4+4H2;
②验证铁用水淬火后的固体产物是否存在+3价的铁,试剂需要用酸溶解固体,且不能把铁氧化,加入铜发生反应产生溶解;
A.H2O2溶液能把亚铁离子氧化为铁离子反应,故A不符合;
B.铜粉和铁离子反应,铜粉溶解,故B符合;
C.稀硫酸溶解固体形成溶液,故C符合;
D.KMnO4溶液具有氧化性把亚铁离子氧化为铁离子干扰检验,故D不符合;
故选BC;
(3)①图象分析可知pH=4.74时,反应从开 始到800min,消耗FeO42-离子浓度为1.0mol/L-0,45mol/L=0.55mol/L,反应的平均反应速率v(FeO42-)=×
=6.9×10-7mol/L?min,故答案为:6.9×10-7mol/L?min;
②平衡常数随温度变化,不随溶液酸碱性,离子浓度变化,随着pH 变大,此反应的平衡常数不变,故答案为:不变;
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,依据图象分析可知随温度升高消耗FeO42-浓度增大,平衡正向进行,温度升高平衡向吸热反应方向进行,故反应 是吸热反应,△H>0,故答案为:>.
 ,
,故答案为:
 ;
;②以Mg、Al为电极,负极的电极反应式为:Al+4OH--3e-=[Al(OH)4]-,故答案为:Al+4OH--3e-=[Al(OH)4]-;
(2)①使用水进行淬火,若生成磁性氧化铁,反应的化学方程式是铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
| ||
故答案为:3Fe+4H2O
| ||
②验证铁用水淬火后的固体产物是否存在+3价的铁,试剂需要用酸溶解固体,且不能把铁氧化,加入铜发生反应产生溶解;
A.H2O2溶液能把亚铁离子氧化为铁离子反应,故A不符合;
B.铜粉和铁离子反应,铜粉溶解,故B符合;
C.稀硫酸溶解固体形成溶液,故C符合;
D.KMnO4溶液具有氧化性把亚铁离子氧化为铁离子干扰检验,故D不符合;
故选BC;
(3)①图象分析可知pH=4.74时,反应从开 始到800min,消耗FeO42-离子浓度为1.0mol/L-0,45mol/L=0.55mol/L,反应的平均反应速率v(FeO42-)=×
| 0.55×10-3mol/L |
| 800min |
②平衡常数随温度变化,不随溶液酸碱性,离子浓度变化,随着pH 变大,此反应的平衡常数不变,故答案为:不变;
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,依据图象分析可知随温度升高消耗FeO42-浓度增大,平衡正向进行,温度升高平衡向吸热反应方向进行,故反应 是吸热反应,△H>0,故答案为:>.
点评:本题考查了微粒结构,原电池原理的分析判断,电极反应书写方法,图象分析应用,平衡常数、化学反应速率概念的理解应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
