��Ŀ����
����Ŀ����Ԫ�صĻ������ڹ�ũҵ�Լ������Ƽ�����;�㷺����Ҳ��Ի��������Ⱦ�������ˮ����������ɵĵ���Ⱦ�ѳ�Ϊһ�������ԵĻ������⡣
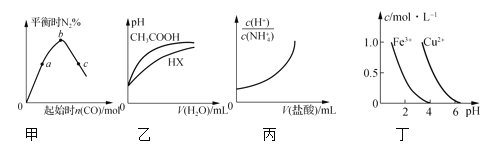
��1���������˷ɴ��Ļ���ƽ����г����£�N2H4����ȼ�ϡ�NH3��NaClO��Ӧ�ɵõ��£�N2H4�����÷�Ӧ�б������뱻��ԭ��Ԫ�ص�ԭ�Ӹ���֮��Ϊ___�������Ӧ����5mol���ӷ���ת�ƣ��ɵõ�___ g�¡�
��2����������25mL0.01mol/Lϡ�����л���ͨ��5.6mLNH3����״������Һ����仯���Բ��ƣ�����Ӧ����Һ������Ũ���ɴ�С��˳����___����ͨ��NH3�Ĺ�������Һ�ĵ�������___����д�������������С��������������������
��3����������Һ�м���ͨ��NH3���ù���������Ũ�ȴ�С��ϵ������ȷ����___��ѡ���ţ���
a��[Cl-]=[NH4+]��[H+]=[OH-] b��[Cl-]��[NH4+]=[H+]��[OH-
c��[NH4+]��[OH-]��[Cl-]��[H+] d��[OH-]��[NH4+]��[H+]��[Cl-]
��4����������25mL��HCl0.01mol����Һ�еμӰ�ˮ���������ù�����ˮ�ĵ���ƽ�⣨��д����ƽ���ƶ������___�����μӰ�ˮ��25mLʱ�������Һ��ˮ�ĵ���������ˮ��Ũ��Ϊ___mol��L-1��
���𰸡�2��1 80 c(Cl-)��c(NH4+)��c(H+)��c(OH-) �������� ac �������ƶ����������ƶ� 0.4
��������
��1��ÿ����1molN2H4ʱ��NH3��ΪN2H4��N���ϼ۴�-3���ߵ�-2������1��NaClO��ΪNaCl��Cl���ϼ۴�+1���͵�-1������2������������ԭ��Ӧ�л��ϼ�����������ȿ�֪��������Nԭ�Ӻͱ���ԭ��Clԭ�Ӹ�����Ϊ2��1��ÿ����1molN2H4��ת��2mol���ӣ���ת��5mol���ӣ�������2.5molN2H4��������Ϊ2.5mol![]() 32g��mol-1=80g���ʴ�Ϊ��2��1��80��
32g��mol-1=80g���ʴ�Ϊ��2��1��80��
��2��HCl�����ʵ���=0.01mol��L-1![]() 25mL
25mL![]() 10-3=2.5
10-3=2.5![]() 10-4mol��NH3�����ʵ���=
10-4mol��NH3�����ʵ���=![]() =2.5
=2.5![]() 10-4mol��HCl��NH3ǡ����ȫ��Ӧ����NH4Cl��������ҺΪNH4Cl��Һ�����ݵ���غ�ɵã�c(NH4+)+c(H+)=c(Cl-)+c(OH-)������NH4+ˮ�������ԣ���Һ������Ũ�ȴ�СΪ��c(Cl-)>c(NH4+)>c(H+)>c(OH-)��ͨ�백�����������ӷ�ӦΪ��NH3+H+=NH4+��ÿ����1molH+����1molNH4+,��Һ������Ũ�Ȳ��䣬�����Լ������䣬�ʴ�Ϊ��c(Cl-)>c(NH4+)> c(H+)>c(OH-)���������䣻
10-4mol��HCl��NH3ǡ����ȫ��Ӧ����NH4Cl��������ҺΪNH4Cl��Һ�����ݵ���غ�ɵã�c(NH4+)+c(H+)=c(Cl-)+c(OH-)������NH4+ˮ�������ԣ���Һ������Ũ�ȴ�СΪ��c(Cl-)>c(NH4+)>c(H+)>c(OH-)��ͨ�백�����������ӷ�ӦΪ��NH3+H+=NH4+��ÿ����1molH+����1molNH4+,��Һ������Ũ�Ȳ��䣬�����Լ������䣬�ʴ�Ϊ��c(Cl-)>c(NH4+)> c(H+)>c(OH-)���������䣻
��3������غ㣺c��NH4+��+c(H+)=c(Cl-)+c(OH-)������Һ������ʱ��c(Cl-)=c(NH4+)> c(H+)=c(OH-)������Һ�ʼ���ʱc(NH4+)>c(OH-)> c(Cl-)>c(H+)��ac���ϣ��ʴ�Ϊ��ac��
��4���μ�ǰ��Һ����ΪHCl������ˮ�ĵ��룬�μӵ�ǡ����ȫ��Ӧ����ΪNH4Cl��NH4+ˮ�⣬����ˮ�⣬�ٽ�ˮ�ĵ��룬����������Һ��Һ��NH3��H2OŨ����������ˮ�ĵ��룬������������ˮ�ĵ���ƽ���������ƶ����������ƶ����μӵ�ǡ����ȫ��Ӧ����ΪNH4Clʱ��ˮ�ĵ���̶������0.01mol=c(NH3��H2O)![]() 25mL
25mL![]() 10-3�����c
10-3�����c
(NH3��H2O)=0.4mol��L-1���ʴ�Ϊ���������ƶ����������ƶ���0.4��

����Ŀ��ij��ѧ��ȤС����ȡ����غ���ˮ�������й�̽��ʵ�顣
ʵ��һ ��ȡ����غ���ˮ
������ͼ��ʾ��ʵ��װ�ý���ʵ�顣
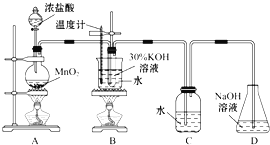
��1����ȡʵ�������ȡ��B���Թ���ȴ�ᾧ�����ˣ�ϴ�ӡ���ʵ�����������Ҫ�IJ���������______��
��2�����Ե�B��Cװ�õ�λ�ã�_____�����������������������������B������صIJ��ʡ�
ʵ��� �������⻯�ط�Ӧ���о�
��3���ڲ�ͬ������KClO3�ɽ�KI����ΪI2��KIO3����С�������ϵ��ʵ���о���Ӧ�����Է�Ӧ�����Ӱ�죬����ϵ��aʵ��ļ�¼�����£�ʵ���������½��У���
�Թܱ�� | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3��s��/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
����ˮ/mL | 9.0 | 6.0 | 3.0 | 0 |
ʵ������ |
��ϵ��aʵ���ʵ��Ŀ����______��
�����1���Թ�ʵ���������______��
����2���Թ�ʵ����������Һ��Ϊ��ɫ��ȡ��������Һ����______��Һ����ɫ��
ʵ���� �ⶨ������ˮ����Ԫ�ص�����
��4�������������ϣ�Ϊ��С�����һ�����е�ʵ�鷽�������������������̵�ϸ�ڣ���_____��
���ϣ��ٴ�������ƻ����ָʾ����
�ڴ��������ˮ�ɱ�SO2��H2O2��FeCl2�����ʻ�ԭ��Cl-��