题目内容
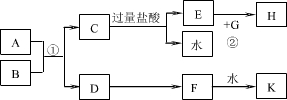
中学化学中几种常见物质的转化关系如图所示:

已知:B、C、D为常见单质,其中C为气休,B、D为金属;F为常见的强酸;K常温下为气体,且能使品红溶液褪色;将E溶液滴入沸水可制得一种红褐色胶体.
请回答下列问题:
(1)若用B作阳极,D作阴极,A溶液为电解质溶液,通电一段时间后,A溶液的pH______(填“变大”、“变小”或“不变”).
(2)写出反应③的离子方程式______,反应④的化学方程式______.
(3)写出检验G溶液中阳离子的方法______.
(4)实验中保存E溶液时要加入______,用必要的文字和离子方程式解释原因______.
(1)若用铜作阳极,铁作阴极,氯化铜溶液为电解质溶液,电解时,阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,阳极上生成的铜离子等于阴极上反应的铜离子,所以实际上溶液中铜离子浓度不变,则通电一段时间后,A溶液的pH不变,故答案为:不变;
(2)铜和氯化铁反应生成氯化亚铁和氯化铜,离子反应方程式为:2Fe3++Cu=2Fe2++Cu2+,加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,故答案为:2Fe3++Cu=2Fe2++Cu2+;Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;(3)铁离子能和硫氰化钾溶液反应生成络合物而使其溶液呈血红色,所以可以用硫氰化钾溶液检验铁离子,亚铁离子被硫氰化钾溶液不反应,要检验亚铁离子,可以向将亚铁离子氧化生成铁离子,再用硫氰化钾溶液检验铁离子,所以检验亚铁离子的方法是:取G溶液少许于试管中,滴加KSCN溶液,没明显现象,再加入氯水溶液变成血红色,证明G溶液中含而Fe2+,
故答案为:取G溶液少许于试管中,滴加KSCN溶液,没明显现象,再加入氯水溶液变成血红色,证明G溶液中含而Fe2+;
(4)氯化铁是强酸弱碱盐,铁离子易水解生成氢氧化铁,为防止其水解,可以向其溶液中加入适量盐酸,离子反应方程式为:Fe3++3H2O?Fe(OH)3+3H+,
故答案为:加入适量的稀盐酸;Fe3++3H2O?Fe(OH)3+3H+,加盐酸抑制Fe3+的水解.
分析:将E溶液滴入沸水可制得一种红褐色胶体,则E含有铁离子,C是气体单质,D是常见单质,且E中含有铁离子,则D是铁,C是氯气,E是氯化铁,K常温下为气体,且能使品红溶液褪色,生成K的同时还生成水,所以K是二氧化硫,B和氯化铁反应生成A和G,B是常见金属单质,且和强酸反应生成二氧化硫,则F是浓硫酸,浓硫酸和铝发生钝化现象,所以B是铜,A是氯化铜,G是氯化亚铁.
点评:本题考查了物质的推断,明确物质的性质及特殊颜色是解本题关键,涉及盐类水解、离子检验、电解原理等知识点,注意基础知识的积累和运用,难度中等.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
 |
已知:A、B、C、D、E是单质,组成它们的元素的原子序数依次为a、b、c、d、e;且3(a + b) = 2(a + c) = 3(d -a),X、Y、Z、M、N、W、H、K是化合物,其中X是B和C的化合产物的水溶液。请回答下列问题:
(1)用电子式表示X中溶质的形成过程:_______________,组成C的元素的原子结构示意图是_____ 。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式:_______________。
(3)组成单质B、C、D的三种元素简单离子的离子半径由大到小的顺序是__ _(用离子符号表示)。
(4)写出K与过量的氨水反应的化学方程式 ;写出M在水溶液中电离的方程式 。
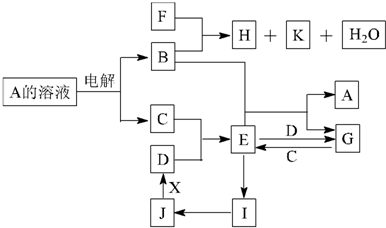
中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):
已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,目能使品红溶液褪色;将 E 溶液滴入沸水可制得一种红褐色胶体; J 为红棕色固体。请回答下列问题:
 |
( l ) B 的化学式为 ;
写出 B 与 F 反应的化学方程式
( 2)实验中保存 G 溶液时要加入 目的是
( 3)为实现J一D的变化,若X是非金属单质,则X可能是 (写化学式); 若X是金属单质,请写出 J 一 D 反应的化学方程式