题目内容
氯气是一种重要的化工原料,实验室制取氯气的化学方程式为:4HCl(浓)+MnO2
| ||
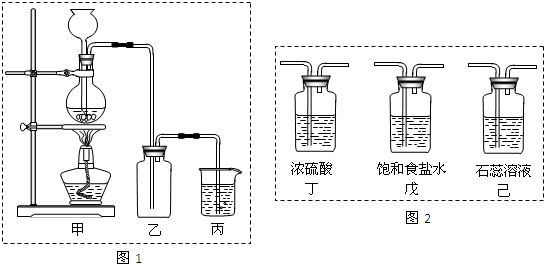
某课外学习小组设计了如下装置制取氯气并验证氯气的某些性质.

请回答:
(1)装置A中仪器甲的名称为
(2)装置B中浓硫酸的作用是
(3)装置C中的现象
(4)装置D为氯气的收集装置,a处应连接
(5)装置E的作用是
分析:(1)根据常见仪器的名称和用途解答;
(2)根据杂质的成分及性质分析;
(3)氯气没有漂白性,次氯酸有漂白性,干燥的红色布条没有明显变化,湿润的红色布条褪色;
(4)氯气的密度比空气大,需用向上排空气法收集;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收;
(2)根据杂质的成分及性质分析;
(3)氯气没有漂白性,次氯酸有漂白性,干燥的红色布条没有明显变化,湿润的红色布条褪色;
(4)氯气的密度比空气大,需用向上排空气法收集;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收;
解答:解:(1)从题中图可知A是分液漏斗,该实验中盛放浓盐酸,
故答案为:分液漏斗;
(2)该实验的目的是制取氯气并验证氯气的某些性质,需纯净的氯气,浓盐酸有挥发性,用饱和食盐水吸收挥发出来的氯化氢气体,过程中会混有水蒸气,浓硫酸有吸水性,且不和氯气反应,所以用浓硫酸干燥氯气;
故答案为:除去氯气中的水蒸气(或干燥氯气);
(3)干燥的氯气无漂白性,所以装置C中干燥的红色布条没有明显变化,湿润的红色布条中的水和氯气反应生成盐酸和次氯酸,生成的HClO具有漂白性,将湿润的红色布条漂白褪色,
故答案为:干燥的红色布条没有明显变化,湿润的红色布条褪色;
(4)氯气的密度比空气大,需用向上排空气法收集需长管进短管出,所以连接c,
故答案为:c;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收过量的氯气,反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O,
故答案为:吸收过量的氯气;2NaOH+Cl2═NaCl+NaClO+H2O.
故答案为:分液漏斗;
(2)该实验的目的是制取氯气并验证氯气的某些性质,需纯净的氯气,浓盐酸有挥发性,用饱和食盐水吸收挥发出来的氯化氢气体,过程中会混有水蒸气,浓硫酸有吸水性,且不和氯气反应,所以用浓硫酸干燥氯气;
故答案为:除去氯气中的水蒸气(或干燥氯气);
(3)干燥的氯气无漂白性,所以装置C中干燥的红色布条没有明显变化,湿润的红色布条中的水和氯气反应生成盐酸和次氯酸,生成的HClO具有漂白性,将湿润的红色布条漂白褪色,
故答案为:干燥的红色布条没有明显变化,湿润的红色布条褪色;
(4)氯气的密度比空气大,需用向上排空气法收集需长管进短管出,所以连接c,
故答案为:c;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收过量的氯气,反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O,
故答案为:吸收过量的氯气;2NaOH+Cl2═NaCl+NaClO+H2O.
点评:本题综合考查氯气的制备实验的设计,侧重于氯气的除杂、收集、性质以及尾气的吸收等基本实验操作,题目难度不大,注意实验原理和方法.

练习册系列答案
相关题目