题目内容
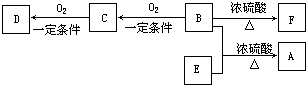
17.接触法生产硫酸的过程中,对废气、废水、废渣、废热的处理正确的是( )①尾气用氨水处理
②污水用石灰乳处理
③废渣用来造水泥、炼铁
④设置废热锅炉产生蒸汽、供热或发电.
| A. | ①②③④ | B. | ①③④ | C. | ①②③ | D. | ①② |
分析 ①二氧化硫为酸性氧化物可与氨水反应;
②硫酸厂废水中含有H2SO4,可用碱吸收;
③硫酸厂废渣中含有SiO2、Fe2O3等,可用于制造水泥、炼铁;
④硫酸生产过程中三个化学反应都是放热反应,为可以充分利用这些反应放出的热能来降低生产成本.
解答 解:①二氧化硫为酸性氧化物可与氨水反应,所以尾气用氨水处理,故正确;
②硫酸厂废水中含有H2SO4,可用石灰乳中和,故正确;
③硫酸厂废渣中含有SiO2、Fe2O3等,可用于制造水泥、炼铁,实现废物再利用,故正确;
④硫酸生产过程中三个化学反应都是放热反应,为可以充分利用这些反应放出的热能来降低生产成本,故正确;
故选:A.
点评 本题考查了环境污染和治理,明确污染物的性质是解题关键,注意遵循节能减排原理.

练习册系列答案
相关题目
8.下列反应中,Q2>Q1的是( )
| A. | H2(g)+F2(g)=2HF(g)△H=-Q1 kJ•mol-1 H2(g)+Cl2(g)=2HCl(g)△H=-Q2 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1 kJ•mol-1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-Q1 kJ•mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-Q2 kJ•mol-1 | |
| D. | S(s)+O2(g)=SO2(g)△H=-Q1 kJ•mol-1 S(g)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1 |
12.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.

(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.

2.由下列结构片段组成的蛋白质在胃液中水解,不可能产生的氨基酸是( )
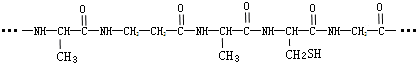

| A. | 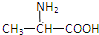 | B. | H2NCH2COOH | C. | 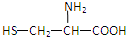 | D. | 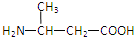 |
9.钠硫电池属于温绿色二次电流,用液态钠、硫和多硫化钠作电极,以能传导钠离子的固体氧化铝作电解质.电池反应为:2Na+xS$?_{充电}^{放电}$Na2Sx.下列有关说法正确的是( )
| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |
1.取一定质量的均匀固体混合物Cu、CuO和Cu2O,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,另一份中加入500mL稀硝酸(其还原产物为NO),固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A. | 2.4mol/L | B. | 1.4mol/L | C. | 1.2mol/L | D. | 0.7mol/L |