题目内容
(11分)
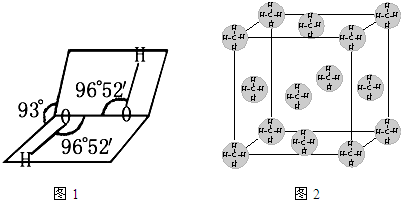
(1)H2O2的水溶液为二元弱酸,科学家对H2O2结构的认识经历了较为漫长的过程,最初他们提出了两种观点:
a. (式中O→O表示共用电子对由前一个氧原子提供)和
b.H—O—O—H
(式中O→O表示共用电子对由前一个氧原子提供)和
b.H—O—O—H
①请用电子式表示b的结构 。
②写出H2O2在水溶液中的电离方程式 。
(2)①用单质碘和氯酸钾可以制得碘酸钾,其中涉及的一个反应为:
I2 + KClO3 + H2O → KH(IO3)2 + KCl + Cl2↑.因此有人认为I2的氧化性强于氯气,你
(填“同意”或“不同意”)该观点,理由是 。
②用电化学方法也可以制碘酸钾.原理是以石墨为阳极,不锈钢为阴极,以碘化钾溶液为电解质溶液,在一定电流和温度下进行电解(同时不断搅拌电解质溶液)其电解总反应式为: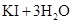

 试写出阳极的电极反应式
。
试写出阳极的电极反应式
。
【答案】
(1)① (2分)
(2分)
②  (2分)
(2分)
(2)①不同意(2分),因为碘在本反应中作还原剂,没有表现氧化性 (2分)
②
 或
或 (3分)
(3分)
【解析】

练习册系列答案
相关题目
某研究小组进行H2O2的性质探究,设计如下几组实验,完成相关内容
(1)H2O2的氧化性:在试管中加入3mL新制的FeSO4溶液,再加入几滴KSCN溶液和稀硫酸,最后加入H2O2溶液.出现的现象是 .
(2)H2O2的还原性:在试管中加入5mL H2O2溶液,加入硫酸酸化的KMnO4溶液,振荡,发现溶液褪色,用带火星的木条伸入试管内,木条复燃.该反应的离子方程式为 .
(3)H2O2的分解:实验如下:
①对比实验1和实验2,得出结论为 .
②对比实验3和实验4,得出结论为 .
③该组实验中H2O2溶液浓度必须 .
(1)H2O2的氧化性:在试管中加入3mL新制的FeSO4溶液,再加入几滴KSCN溶液和稀硫酸,最后加入H2O2溶液.出现的现象是
(2)H2O2的还原性:在试管中加入5mL H2O2溶液,加入硫酸酸化的KMnO4溶液,振荡,发现溶液褪色,用带火星的木条伸入试管内,木条复燃.该反应的离子方程式为
(3)H2O2的分解:实验如下:
| 实验1 | 实验2 | 实验3 | 实验4 | |
| 操作 | 2mL H2O2溶液 | 2mL H2O2溶液 | 2mL H2O2溶液 两滴FeCl3溶液 |
2mL H2O2溶液 两滴过氧化氢酶溶液 |
| 室温 | 90℃(水浴) | 室温 | 室温 | |
| 现象 | 无气泡 | 较少气泡 | 较多气泡 | 很多气泡 |
②对比实验3和实验4,得出结论为
③该组实验中H2O2溶液浓度必须