题目内容
14.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是同周期非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族.下列说法正确的是( )| A. | 元素X、W的简单阴离子具有相同的电子层结构 | |
| B. | 原子半径:r(Y)<r(X)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 由X、Z两种元素组成的化合物是离子化合物,只含有离子键 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,Y是同周期非金属性最强的元素,Y为F;X原子的最外层有6个电子,结合原子序数可知X为O;在周期表中Z位于IA族,Z为Na,W与X属于同一主族,W为S,以此来解答.
解答 解:由上述分析可知,X为O,Y为F,Z为Na,W为S,
A.元素X、W的简单阴离子具有相同的电子层结构,分别为10电子、18电子微粒,故A错误;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:r(Y)<r(X)<r(W)<r(Z),故B正确;
C.非金属性Y>W,则W的简单气态氢化物的热稳定性比Y的弱,故C错误;
D.X、Z两种元素组成的化合物是离子化合物,若为过氧化钠时含离子键、共价键,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子序数、元素的位置来推断原子为解答的关键,侧重分析与应用能力的考查,注意规律性知识及元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
5.利用铝热反应原理可以制取锰,化学方程式为3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,该反应的氧化剂是( )
| A. | MnO2 | B. | Al | C. | Mn | D. | Al2O3 |
2.胆固醇是人体必需的生物活性物质,分子式为C25H46O.已知某种胆固醇酯是液晶材料,分子式为C32H50O2.则生成这种胆固醇酯的酸是( )
| A. | C6H13COOH | B. | C6H5COOH | C. | C7H15COOH | D. | C6H5CH2COOH |
9.某物质的实验式为PtCl4•2NH3,其水溶液不导电.加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | 配合物中中心原子的电荷数为6 | B. | 该配合物可能是平面正方形结构 | ||
| C. | Cl-和NH3分子均与Pt4+形成配位 | D. | 该配合物的配体只有NH3 |
19.科学家刚刚发现了某种元素的原子,其摩尔质量是a g/moL,一个12C原子的质量是b g,NA是阿伏加德罗常数的值,该元素原子的相对原子质量是( )
| A. | $\frac{12a}{{N}_{A}b}$ | B. | $\frac{12a}{b}$ | C. | $\frac{12b}{{N}_{A}a}$ | D. | $\frac{a}{{N}_{A}b}$ |
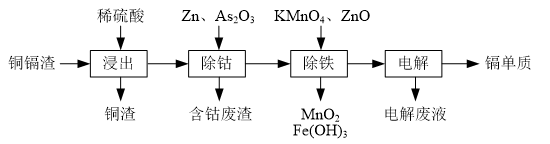
6.湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质.一种由铜镉渣生产金属镉的流程如图:
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是2Cu+4H++O2=2Cu2++2H2O.
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3.该微电池的正极反应式为As2O3+12H++12e-=2AsH3+3H2O.
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH.
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=1:3.
②除铁时加入ZnO控制反应液pH的范围为3.3~7.2.
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余.请设计实验方案加以验证:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6)]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4.

表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3.该微电池的正极反应式为As2O3+12H++12e-=2AsH3+3H2O.
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH.
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=1:3.
②除铁时加入ZnO控制反应液pH的范围为3.3~7.2.
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余.请设计实验方案加以验证:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6)]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4.
3.下列过程既是放热过程又是体系混乱度增加过程的是( )
| A. | 2H2(g)+O2(g)═2H2O(l) | |
| B. | 4Al(s)+3O2(g)═2Al2O3(s) | |
| C. | 2Na(s)+2H2O(l)═2Na+(aq)+2OH- (aq)+H2(g) | |
| D. | 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH- (aq)═BaSO4(s)+2H2O(l) |
4.下列说法正确的是( )
| A. | 分子组成相差一个或若干个CH2原子团的物质互为同系物 | |
| B. | 各元素质量分数相同、相对分子质量也相同,结构不同的化合物互为同分异构体 | |
| C. | 淀粉与纤维素是化学式为(C6Hl0Os)n的同分异构体 | |
| D. | 将2-丙醇与氢氧化钠的醇溶液共热可制备CH3CH=CH2 |
 已知有机物X、M、A,B、C、D有如图所示的转化关系.X是天然的有机高分子化合物,C是食醋的主要成分.
已知有机物X、M、A,B、C、D有如图所示的转化关系.X是天然的有机高分子化合物,C是食醋的主要成分.