题目内容
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 1 mol NaHCO3与足量盐酸反应放出CO2气体的体积为22.4L
B. 1 mol Al3+离子含有的核外电子数为3NA
C. O2和O3的混合气体,质量为48g,所含氧原子数为3NA
D. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2的分子数目为0.3NA
【答案】C
【解析】1 mol NaHCO3与足量盐酸反应放出1 mol CO2气体,不是标况下,无法计算二氧化碳的体积,A错误;1 mol Al3+离子含有的核外电子10 mol,含有的核外电子数为10NA,B错误;48g O2和O3的混合气体中含有O的物质的量为:48/16=3 mol, 所含氧原子数为3NA,C正确;高温下,0.2mol Fe与足量水蒸气反应生成四氧化三铁和氢气,转移电子的物质的量为:![]() ,根据电子守恒可以知道生成氢气的物质的量为:
,根据电子守恒可以知道生成氢气的物质的量为: ,生成的
,生成的![]() 的分子数目为
的分子数目为![]() ,D错误;正确选项C。
,D错误;正确选项C。

【题目】取一定质量的氯化钠、溴化钠、碘化钠的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干,灼烧固体。通入氯气的量与最终所得固体质量记录如下:
编号 | 甲 | 乙 | 丙 | 丁 | 戊 |
固体组成 | NaI、NaBr、NaCl | NaBr、NaCl | NaCl | ||
氯气的体积/ml | V | 2V | 3V | 4V | 5V |
固体质量/g | 54.62 | 43.64 | 35.48 | 30.14 | 29.25 |
求:(1)请填写表中空白______________、____________;
(2)标准状况下氯气的体积V为_______,原混合物中溴化钠的物质的量为_______。
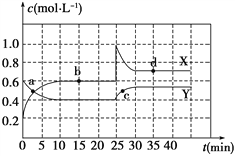
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2molH2O |
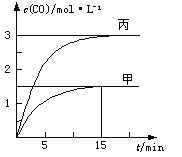
A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1mol·L-1·min-1
B. 丙容器的体积V>0.5 L
C. 当温度为T1℃时,反应的平衡常数K=4.5
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T2< T1