题目内容
【题目】某工厂的工业废水中含有大量的![]() ,较多的
,较多的![]() 和少量
和少量![]() 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。![]() 可供选择的试剂为铁粉、稀
可供选择的试剂为铁粉、稀![]() 、NaOH溶液等试剂
、NaOH溶液等试剂![]()
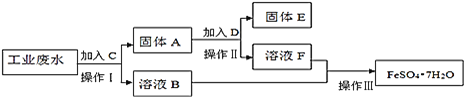
![]() 操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
![]() 固体A的成分为 ______ ,溶液B中含有的离子有 ______
固体A的成分为 ______ ,溶液B中含有的离子有 ______
![]() 加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
![]() 加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
![]() 操作Ⅲ为 ______ 。
操作Ⅲ为 ______ 。
【答案】过滤 漏斗、玻璃棒、烧杯 ![]() 、Cu
、Cu ![]() 、
、![]() 、
、![]() 将
将![]() 全部转化为Cu,以便回收铜单质
全部转化为Cu,以便回收铜单质 ![]() 稀硫酸
稀硫酸 ![]() 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
【解析】
先向工业废水中加过量铁,将铜全部置换出来,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4;向固体A中加入过量稀H2SO4,只有铁溶解,过滤得到固体E(铜),实现了回收金属铜,溶液F含FeSO4、H2SO4;最后溶液B和F合一块,进行蒸发,浓缩,冷却结晶,过滤,就得到FeSO47H2O,回收硫酸亚铁,以此解答该题。
(1)操作Ⅰ为过滤,用于分离固体和液体,用到的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)加入过量的铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤得到固体A,其成分是铜和过量的铁,溶液B中含![]() 和少量
和少量![]() ,则溶液B中含有的离子有:
,则溶液B中含有的离子有:![]() 、
、![]() 、
、![]() ,故答案为:Fe、Cu;
,故答案为:Fe、Cu;![]() 、
、![]() 、
、![]() ;
;
(3)加过量铁,将![]() 全部转化为Cu,以便回收铜单质,发生的化学方程式为:
全部转化为Cu,以便回收铜单质,发生的化学方程式为:![]() ,故答案为:将
,故答案为:将![]() 全部转化为Cu,以便回收铜单质;
全部转化为Cu,以便回收铜单质;![]() ;
;
(4)固体A的成分是铜和过量的铁,向固体A中加入过量D为稀![]() ,目的是将铁溶解,把铜和铁分开,发生反应的离子方程式为:
,目的是将铁溶解,把铜和铁分开,发生反应的离子方程式为:![]() ,
,
故答案为:稀硫酸;![]() ;
;
(5)从溶液B和溶液F中得到![]() 晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

 备战中考寒假系列答案
备战中考寒假系列答案