题目内容
12.为确定铬钾矾xK2SO4•yCr2(SO4)3•zH2O的分子式,配成含此物质31.28g的溶液400mL,取200mL的溶液加入1mol/L的Ba(NO3)2溶液100mL,生成沉淀,过滤后滤液中加入0.1mol/L H2SO4溶液,消耗200mL硫酸时沉淀恰好完全,用过量氨水处理剩余的200mL溶液,生成Cr(OH)3沉淀4.12g,试确定x、y、z的值.分析 根据Cr(OH)3沉淀的质量为4.12g求出其物质的量,然后根据铬离子的守恒可求出铬钾钒中含有的Cr2(SO4)3的物质的量,从而能求出含有的硫酸根的物质的量,然后根据消耗的硝酸钡的物质的量为0.1mol,即可求出硫酸钾的物质的量;
而铬钾钒中含有的水的质量m=$\frac{31.28g}{2}$-m(K2SO4)-m(Cr2(SO4)3),从而求出水的物质的量,即可求出x:y:z.
解答 解:由于生产的Cr(OH)3沉淀的质量为4.12g,故其物质的量n=$\frac{4.12g}{103g/mol}$=0.04mol,根据铬离子的守恒可知铬钾钒中含有的Cr2(SO4)3的物质的量n=0.02mol.0.02molCr2(SO4)3的中含有硫酸根为0.06mol,由于铬钾钒和硫酸共消耗的硝酸钡的物质的量为0.1mol,根据硫酸根的守恒可知,硫酸钾的物质的量n=1mol/L×0.1L-0.1mol/L×0.2L-0.06mol=0.02mol.
故铬钾钒中含有的水的质量m=$\frac{31.28g}{2}$-m(K2SO4)-m(Cr2(SO4)3)=15.64g-0.02mol×174g/mol-0.02mol×392g/mol=4.32g
则水的物质的量n=$\frac{4.32g}{18g/mol}$=0.24mol
故x:y:z=0.02mol:0.02mol:0.24mol=1:1:12,故x=1,y=1,z=12.
答:铬钾钒中x=1,y=1,z=12.
点评 本题考查了有关化学式的计算,理清计算步骤和方法是关键,综合性较强,应注意加强有关训练.

练习册系列答案
 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
20.在标准状况下,下列物质所占体积最大的是( )
| A. | 98gH2SO4 | B. | 56gFe | C. | 44.8LHCI | D. | 6gH2 |
6.某温度时,分4次分别在100g水中加入KNO3固体,充分搅拌后过滤,所得溶液的质量如表所示,则下列说法不正确的是:( )
| 加KNO3的次数 | 1 | 2 | 3 | 4 |
| 加KNO3的质量(g) | 15 | 30 | 45 | 60 |
| 所得溶液质量(g) | 115 | 130 | 145 | 145 |
| A. | 该温度下KNO3的溶解度为45g | |
| B. | 第2次加入KNO3后所得溶液为不饱和溶液 | |
| C. | KNO3属于易溶的盐 | |
| D. | 第4次加入KNO3后所得溶液的质量分数为45% |
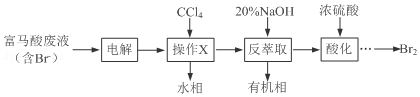
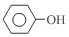 +3Br2→
+3Br2→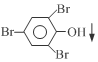 +3HBr
+3HBr
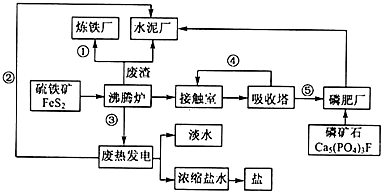 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.