题目内容
已知2SO2 (g) + O2 (g)  2SO3 (g) ΔH = -197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2 (乙) 1 mol SO2和0.5 mol O2 (丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g) ΔH = -197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2 (乙) 1 mol SO2和0.5 mol O2 (丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙 > 2P乙
B.SO3的质量m:m甲=m丙 > 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙 > 2Q乙
B
【解析】
试题分析:(甲) 2 mol SO2和1 mol O2 (乙)通入1mol SO2和0.5molO2,(丙) 2 mol SO3 ,甲和丙等效,甲与乙起始n(SO2):n(O2)=2:1,甲等效为在乙的基础上增大一倍压强,,平衡向正反应移动P甲=P丙 < 2P乙 ,A错误;甲中转化率增大m甲=m丙 > 2m乙,B正确;平衡常数只受温度影响,温度不变,平衡常数均不变,C错误;平衡向正向移动,故Q甲>2Q乙,Q甲+Q丙 =197kJ/mol,故Q甲=Q丙 > 2Q乙不正确,D错误;故答案选B.
考点:平衡移动、化学平衡常数

下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
B | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 证明溶液中含有SO42- |
C | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水 ,石灰水变浑浊 | 证明该溶液中存在CO32- |
D | 向0.1mol?L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色 | 说明Fe2+具有氧化性 |
(8分)某温度下在容积固定的密闭容器中,下列反应达到平衡:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
初始投料比n(CO):n(H2O) | CO转化率 | H2O转化率 |
1:1 | 0.5 | 0.5 |
1:2 | 0.67 | 0.335 |
1:3 | 0.75 | 0.25 |
(1)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H= -44kJ/mol,写出CO(g)和H2O(g)反应的热化学方程式 。
(2)该反应的平衡常数为 。该温度下,向该容器中充入1mol CO、3molH2O(g)、2mol CO2、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
(3)结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,则二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1:4时,CO的转化率为0.85
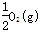 =H2O(l) △H3= _285.8kJ/mol
=H2O(l) △H3= _285.8kJ/mol 
 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是