题目内容
3.物质的量浓度相等的下列溶液,pH值由大到小的顺序是( )| A. | NH4Cl NaCl NaHCO3 Na2CO3 | |
| B. | NaHCO3 Na2CO3 NH4Cl NaCl | |
| C. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| D. | Na2CO3 NH4Cl NaHCO3 NaCl |
分析 相同温度下,等物质的量浓度的这几种溶液中,酸的pH小于盐溶液,强酸弱碱盐溶液呈弱酸性、强碱弱酸盐溶液呈碱性,据此判断溶液pH大小.
解答 解:等浓度溶液中,Na2CO3溶液水解程度大于NaHCO3溶液,溶液呈碱性,溶液PH,Na2CO3>NaHCO3、NaCl是中性溶液PH=7,NH4Cl溶液中铵根离子水解显酸性,溶液PH<7,Na2CO3、NaHCO3、NaCl、NH4Cl溶液pH值符合由大到小的顺序,故C正确;
故选C.
点评 本题考查了弱电解质的电离及盐类水解,根据“谁强谁显性、谁弱谁水解、强强显中性”确定盐溶液酸碱性,从而确定溶液pH大小,题目难度不大.

练习册系列答案
相关题目
12.合理饮食是保证我们身体健康的前提,下列关于饮食的说法不正确的是( )
| A. | 水果、蔬菜含有丰富的维生素,若要减肥,每天只吃水果、蔬菜即可 | |
| B. | 米饭含有大量的淀粉,成人每天食用量不能超过500g | |
| C. | 要促进身体健康,饮食必须合理搭配 | |
| D. | 鸡蛋含有丰富的蛋白质,人体所需的蛋白质可由鸡蛋提供,青少年可适当多吃 |
14.下列说法中不正确的是( )
| A. | 碳原子与碳原子之间形成的σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 乙炔分子中,共含有4个σ键,1个π键 | |
| D. | 共价单键都属于σ键,π键只存在于双键或叁键中 |
11.天平左右两盘的烧杯中放有足量的盐酸,天平已达平衡,现向左盘烧杯中加入2.3g Na,若要使天平仍保持平衡,则应在右盘烧杯中加入( )
| A. | 2.3g Mg | B. | 2.7g Al | C. | 2.4 g Mg | D. | 2.8g Fe |
18.绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求.理想的“原子经济性”反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放.以下反应中符合绿色化学原理的是( )
| A. | 乙烯与氧气在银催化作用下生成环氧乙烷(  ) ) | |
| B. | 乙烷与氯气制备氯乙烷 | |
| C. | 苯和乙醇为原料,在一定条件下生产乙苯 | |
| D. | 乙醇与浓硫酸共热制备乙烯 |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3•H2O分子数为0.1 NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2 NA | |
| C. | 标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2 NA | |
| D. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1 NA |
15.1克SO2含有n个O原子,则阿佛加德罗常数可表示为( )
| A. | 64n | B. | $\frac{1}{64}$n | C. | 32n | D. | $\frac{3}{64}$n |
12.下列各组中物质分别加入适量溴水,可使溴水都变成无色的是( )
| A. | AgNO3溶液、KOH溶液、K2SO3溶液、KI溶液 | |
| B. | 苯酚溶液、CCl4溶液、氯水、氨水 | |
| C. | 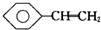 、CH3-C≡CH、福尔马林、乙醛 、CH3-C≡CH、福尔马林、乙醛 | |
| D. | NaOH溶液、FeCl2溶液、亚硫酸溶液、KCl溶液 |
13.(1)证明海带中含有碘元素的实验方案如表,请你按要求补充完整:
(2)利用新制氯水、1mol/L NaBr溶液、淀粉液、以及II中所得滤液,验证卤素单质氧化性的相对强弱.
V分别取5mL 1mol/L NaBr溶液于两支小试管中
Ⅵ向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
ⅥⅠ向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
ⅥⅡ…
④请写出步骤VI中反应的离子方程式Cl2+2Br-=Br2+2Cl-;为验证溴的氧化性强于碘,步骤VIII的操作和现象是:将VI所得黄色溶液滴入II所得滤液中,溶液变为黄色,再加入淀粉溶液,溶液变为蓝色.
⑤步骤ⅥⅠ的目的是确认VI所得黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰.
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增大,则原子半径逐渐增大,得电子能力逐渐减弱,非金属性减弱.
| 步骤 | 实验过程 | 实验用品 |
| Ⅰ | 将干海带灼烧灰化 | 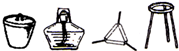 |
| Ⅱ | 将海带灰溶解、过滤 |  和①玻璃棒(玻璃仪器名称) |
| Ⅲ | 氧化滤液中的I-,反应的离子方程式为②2I-+H2O2+2H+=I2+2H2O | 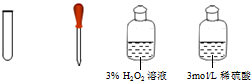 |
| Ⅳ | 取少量Ⅲ中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③下层溶液变为紫红色,说明海带中含有碘元素. | 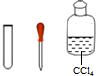 |
V分别取5mL 1mol/L NaBr溶液于两支小试管中
Ⅵ向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
ⅥⅠ向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
ⅥⅡ…
④请写出步骤VI中反应的离子方程式Cl2+2Br-=Br2+2Cl-;为验证溴的氧化性强于碘,步骤VIII的操作和现象是:将VI所得黄色溶液滴入II所得滤液中,溶液变为黄色,再加入淀粉溶液,溶液变为蓝色.
⑤步骤ⅥⅠ的目的是确认VI所得黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰.
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增大,则原子半径逐渐增大,得电子能力逐渐减弱,非金属性减弱.