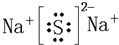题目内容
现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于ⅤA族的有:
(2)处于第二周期的元素有:
(3)写出②、⑤的元素符号:
(4)④和⑤两元素中非金属性较强的是(写元素名称)
(5)由五个⑦原子形成一种显电性的粒子,该粒子中每个⑦原子均满足8电子结构,且五个⑦原子排成V型,则该粒子的表达式是
| 元素编号元素性质 | ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于ⅤA族的有:
④⑦
④⑦
(用编号表示)(2)处于第二周期的元素有:
①③⑦
①③⑦
被称为“矾”的一类化合物中肯定含有表中①
①
(以上均用编号表示).(3)写出②、⑤的元素符号:
Mg、Cl
Mg、Cl
(4)④和⑤两元素中非金属性较强的是(写元素名称)
Cl
Cl
写出证明这一结论的一个实验事实.高氯酸酸性比磷酸强(氯化氢比磷化氢稳定)
高氯酸酸性比磷酸强(氯化氢比磷化氢稳定)
(5)由五个⑦原子形成一种显电性的粒子,该粒子中每个⑦原子均满足8电子结构,且五个⑦原子排成V型,则该粒子的表达式是
N5+
N5+
.分析:(1)元素的最高正价=最外层电子数=族序数;
(2)根据元素的名称来确定所在的周期数,属于“矾”的一类化合物是均含有结晶水的化合物;
(3)根据化合价和半径的相对大小确定元素;
(4)同周期元素的原子从左到右元素非金属性逐渐增强;
(5)根据微粒的空间构型和原子结构知识来回答.
(2)根据元素的名称来确定所在的周期数,属于“矾”的一类化合物是均含有结晶水的化合物;
(3)根据化合价和半径的相对大小确定元素;
(4)同周期元素的原子从左到右元素非金属性逐渐增强;
(5)根据微粒的空间构型和原子结构知识来回答.
解答:解:元素的最高正价=最外层电子数=族序数,同周期元素从左到右原子半径逐渐减小,最高正价+|最低负价|=8,F元素没有正价,所以⑤是Cl,①是O,⑦是第ⅤA族,但是原子半径小于O,所以是N,④是P,②的半径比P大,是第ⅡA元素,应为Mg,③的原子半径比Mg大,是第ⅠA元素,即为金属Li,⑥和Li是一主族,半径比金属li大,所以是金属Na.
(1)上述元素中处于ⅤA族的是最高正价为+5价的N和P,故答案为:④⑦;
(2)处于第二周期的元素有Li、N、O,属于“矾”的一类化合物是均含有结晶水的化合物,均含氧元素,故答案为:①③⑦;①;
(3)②、⑤的元素符号分别是:Mg、Cl,故答案为:Mg、Cl;
(4)P、Cl是同一周期元素的原子,同周期元素的原子从左到右元素非金属性逐渐增强,所以非金属性较强的是Cl,能证明这一结论的实验事实是高氯酸酸性强于磷酸,或者氯化氢的稳定性强于磷化氢,故答案为:Cl;高氯酸酸性比磷酸强(氯化氢比磷化氢稳定);
(5)N5+是由五个N原子形成一种显电性的粒子,该粒子中每个N原子均满足8电子结构,且五个N原子排成V型,故答案为:N5+.
(1)上述元素中处于ⅤA族的是最高正价为+5价的N和P,故答案为:④⑦;
(2)处于第二周期的元素有Li、N、O,属于“矾”的一类化合物是均含有结晶水的化合物,均含氧元素,故答案为:①③⑦;①;
(3)②、⑤的元素符号分别是:Mg、Cl,故答案为:Mg、Cl;
(4)P、Cl是同一周期元素的原子,同周期元素的原子从左到右元素非金属性逐渐增强,所以非金属性较强的是Cl,能证明这一结论的实验事实是高氯酸酸性强于磷酸,或者氯化氢的稳定性强于磷化氢,故答案为:Cl;高氯酸酸性比磷酸强(氯化氢比磷化氢稳定);
(5)N5+是由五个N原子形成一种显电性的粒子,该粒子中每个N原子均满足8电子结构,且五个N原子排成V型,故答案为:N5+.
点评:本题考查学生元素周期表的结构以及元素周期律的相关知识,可以根据所学知识进行回答,综合性较强,难度较大.

练习册系列答案
相关题目