题目内容
20.下列关于溶液中的离子共存问题或者离子反应的说法中正确的是( )| A. | c(Fe3+)=0.1mol•L -1的溶液中:K+、NH4+、CO32-、SO42-能共存 | |
| B. | 与Al反应产生H2的溶液中,NO3-、Na+、SO42-、Fe2+一定不共存 | |
| C. | NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 用铜作电极电解NaCl溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
分析 A.离子之间相互促进水解;
B.与Al反应产生H2的溶液,为非氧化性酸或强碱溶液;
C.发生氧化还原反应生成硫酸钠;
D.用铜作电极,阳极Cu失去电子.
解答 解:A.Fe3+、CO32-相互促进水解,不能大量共存,故A错误;
B.与Al反应产生H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Fe2+,酸溶液中Fe2+、NO3-发生氧化还原反应,一定不能大量共存,故B正确;
C.发生氧化还原反应生成硫酸钠,离子方程式为3ClO-+SO2+H2O=Cl-+SO42-+2HClO,故C错误;
D.用铜作电极,阳极Cu失去电子,离子反应为Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↑+H2↑,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意电解反应、氧化还原反应,题目难度不大.

练习册系列答案
相关题目
11.X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
(1)X、W的化学式分别为NaOH、NH4NO3.
(2)HNO2在溶液中的电离方程式为HNO2?H++NO2-
(3)25℃时,W溶液的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)HNO2在溶液中的电离方程式为HNO2?H++NO2-
(3)25℃时,W溶液的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
8.在1~20号元素中关于某些元素的性质说法错误的是( )
| A. | Cl的最高氧化物对应的水化物酸性最强 | |
| B. | S元素的族序数等于周期数3倍 | |
| C. | C元素的最高正价与最低负价代数和为零 | |
| D. | N元素的气态氢化物和它的最高价氧化物对应水化物能起化合反应 |
5.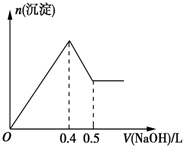 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 6:1 | B. | 2:3 | C. | 1:3 | D. | 3:1 |
12.合金是一类用途广泛的金属材料.下列物质中,不属于合金的是( )
| A. | 水银 | B. | 青铜 | C. | 碳素钢 | D. | 不锈钢 |
9.下列关于乙烯和乙烷的说法中,错误的是( )
| A. | 乙烯是不饱和烃,乙烷是饱和烃 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,乙烷则不能 | |
| C. | 乙烯分子中存在碳碳双键,乙烷分子中存在碳碳单键,因此乙烯比乙烷稳定 | |
| D. | 乙烯分子为平面形结构,乙烷分子为立体结构 |
10.沸腾时只需克服范德华力的液体物质是( )
| A. | 水 | B. | 酒精 | C. | 四氯化碳 | D. | 氨水 |