题目内容
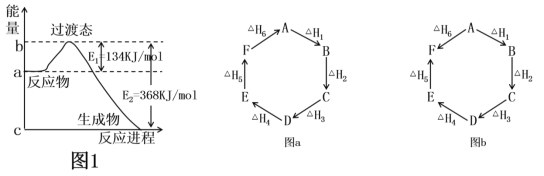
【题目】(1)如图1是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。请写出NO2和CO反应的热化学方程式:________________。
(2)观察图a和图b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系。图a:________________________;图b:_________________________。
(3)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:① H2O(l)=H2O(g) △H=+44 kJ/mol
② 2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) △H= +1160 kJ/mol
③ CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ/mol
请写出CH4(g)与NO2(g)反应生成参与大气循环的气体和液态水的热化学方程式________。
【答案】减小 不变 NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ/mol △H1+△H2+△H3+△H4+△H5+△H6=0 △H1+△H2+△H3+△H4+△H5=△H6 CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955kJ/mol
【解析】
(1)若在反应体系中加入催化剂,活化能降低,则E1减小;由图可以知道,ΔH =E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol;1molNO2(g)和1molCO(g)反应生成CO2和NO,则NO2和CO反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ/mol;
(2)图a:以A为起点,最终回到A,整个过程没有能量变化,所以△H1+△H2+△H3+△H4+△H5+△H6=0;图b:变化有两个途径A→F,A→B→C→D→E→F,两个途径的热效应相同,所以△H1+△H2+△H3+△H4+△H5=△H6;
(3)① H2O(l)=H2O(g) △H=+44 kJ/mol
② 2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) △H= +1160 kJ/mol
③ CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ/mol
则-2×①-![]() ×②+
×②+![]() ×③,得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l),且△H=-2×(+44 kJ/mol)-
×③,得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l),且△H=-2×(+44 kJ/mol)-![]() ×(+1160 kJ/mol)+
×(+1160 kJ/mol)+![]() ×(-574 kJ/mol)= -955kJ/mol,则CH4(g)与NO2(g)反应生成参与大气循环的气体和液态水的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955kJ/mol。
×(-574 kJ/mol)= -955kJ/mol,则CH4(g)与NO2(g)反应生成参与大气循环的气体和液态水的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955kJ/mol。

【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:

已知:①有关A的信息如下:
能发生银镜反应 |
与FeCl3溶液发生显色反应 |
核磁共振氢谱显示有4组峰,峰面积之比为1∶2∶2∶1 |
②R1—CHO+R2—CH2—CHO![]()
![]()
回答以下问题:
(1)A中含有的含氧官能团名称是__________和_________。
(2)写出反应类型:G→H:_________,I→J:____________。
(3)写出下列过程化学方程式。
F→G_____________。B→C__________________。
(4)写出J的结构简式______________。
(5)结合题给信息,以D为原料经过三步反应制备1,3—丁二烯,设计合成路线(其他试剂任选)__________________________________________。
合成路线流程图示例:





