题目内容
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.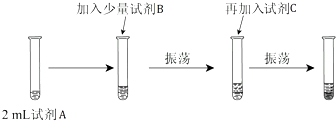
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .
【答案】
(1)性质(或金属性与非金属性)的递变规律;生成浅黄色沉淀|;Cl2+Na2S=S↓+2NaCl
(2)NaBr溶液;氯水;四氯化碳;萃取生成的溴,使现象更明显;;液体分成两层,上层接近无色、下层为橙色,;强于; Cl2+2Br﹣=2Cl﹣+Br2
【解析】解:【实验一】(1)(i)由实验步骤可知,实验序号①比较S、Cl的非金属性强弱,实验序号②③,比较Mg、Al的金属性强弱,所以实验目的是性质(或金属性与非金属性)的递变规律,
所以答案是:性质(或金属性与非金属性)的递变规律;
(ii)氯水与硫化钠反应生成S与NaCl,反应方程式为:Cl2+Na2S=S↓+2NaCl,现象:生成浅黄色沉淀,
所以答案是:生成浅黄色沉淀;Cl2+Na2S=S↓+2NaCl;
(2)(iii)【实验二】要想比较氯气和溴单质的氧化性大小,做如下实验:试剂A,取少量溴化钠反应→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴.
所以答案是:NaBr溶液;氯水;四氯化碳;
(iv)溴单质在四氯化碳中的溶解度大于在水中的溶解度,水和四氯化碳是互不相溶的,所以试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色;氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为:Cl2+2Br﹣=Br2+2Cl﹣ .
所以答案是:萃取生成的溴,使现象更明显;液体分成两层,上层接近无色、下层为橙色,强于 Cl2+2Br﹣=2Cl﹣+Br2 .

【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 , 该反应为反应(填“放热”或“吸热”).
(2)t1=s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度) .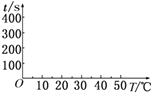
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是 .
(4)t1(填“>”或“<”)t4 , 原因是 .
t2t3(填“>”或“<”),原因是 .