题目内容
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式为K=________;
(2)若知上述反应为放热反应,则升高温度,其平衡常数值________(选填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18 mol·L-1·min-1,则N2消耗速率为v(N2)=________.
(3)达到平衡后,改变某一外界条件,反应速率与时间t的关系如图:
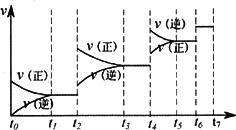
若不改变N2、CO的量,则图中t.时引起平衡移动的条件可能是________;图中t6时引起变化的条件是________;图中表示平衡混合物中CO的含量最高的一段时间是________.

 阅读快车系列答案
阅读快车系列答案(14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)该反应的温度控制在1300-1700oC的原因是 。
(4)某温度下,测得该反应中N2和CO各个时刻的浓度如下,则0—20 min内N2的平均
反应速率 ,在平衡混合气体中CO的体积分数是 。
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
N2浓度 /mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
|
CO浓度 /mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
— |
— |
— |