题目内容
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出X kJ热量.已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为( )
| A、-(5X-0.5Y)kJ/mol |
| B、-Y kJ/mol |
| C、-(10X-Y)kJ/mol |
| D、+(10X-Y)kJ/mol |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:3.6gC的物质的量为:3.6g÷12g/mol=0.3mol,6.4g氧气的物质的量为:6.4g÷32g/mol=0.2mol,反应物耗尽,生成物有CO和CO2,设有CO的物质的量为x,据C原子守恒,则CO2的物质的量有0.3-x,据O原子守恒得:x+2×(0.3-x)=2×0.2,x=0.2,即反应后有CO:0.2mol,CO2:0.1mol,C的燃烧热是指1molC完全燃烧生成CO2时放出的热量,综上,生成0.2molCO放出的热量为:(X-0.1Y)KJ,则1molC燃烧生成CO放出的热量为5(X-0.1Y),据此解答.
解答:
解:3.6gC的物质的量为:3.6g÷12g/mol=0.3mol,6.4g氧气的物质的量为:6.4g÷32g/mol=0.2mol,反应物耗尽,生成物有CO和CO2,
设有CO的物质的量为x,据C原子守恒,则CO2的物质的量有0.3-x,据O原子守恒得:x+2×(0.3-x)=2×0.2,x=0.2,
即反应后有CO:0.2mol,CO2:0.1mol,
C的燃烧热是指1molC完全燃烧生成CO2时放出的热量,
综上,生成0.2molCO放出的热量为:(X-0.1Y)KJ,则1molC燃烧生成CO放出的热量为5(X-0.1Y),其△H=-(5X-0.5Y),
故选:A.
设有CO的物质的量为x,据C原子守恒,则CO2的物质的量有0.3-x,据O原子守恒得:x+2×(0.3-x)=2×0.2,x=0.2,
即反应后有CO:0.2mol,CO2:0.1mol,
C的燃烧热是指1molC完全燃烧生成CO2时放出的热量,
综上,生成0.2molCO放出的热量为:(X-0.1Y)KJ,则1molC燃烧生成CO放出的热量为5(X-0.1Y),其△H=-(5X-0.5Y),
故选:A.
点评:本题首先要理解燃烧热的概念,并会运用原子守恒原理解决问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于平衡常数(K)的说法中正确的是( )
| A、相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 | ||
| B、相同温度下,水的离子积常数就是水的电离平衡常数 | ||
C、由K水解=
| ||
| D、同温同浓度条件下,一元弱酸的电离平衡常数(K)越小,则溶液的pH越小 |
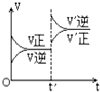 对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )
对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )| A、X、Y、W为气体,Z不是气体 |
| B、X、Y为气体,W、Z中有一种是气体 |
| C、W、Z为气体,X、Y中有一种是气体 |
| D、W、Z中有一种为气体,X、Y都不是气体 |
下列关于化学键的说法正确的( )
| A、只存在于分子之间 |
| B、相邻原子间强烈的相互作用 |
| C、只存在于离子之间、 |
| D、相邻分子间的相互作用 |
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的洗气瓶.
| A、澄清石灰水,浓H2SO4 |
| B、KMnO4酸性溶液,浓H2SO4 |
| C、溴水,烧碱溶液,浓硫酸 |
| D、NaOH溶液,浓H2SO4 |
在100℃时,NaCl溶液中c(H+)=1×10-6 mol/L.下列说法中正确的是( )
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液显碱性 |
| C、该NaCl溶液中KW=c(H+)?c(OH-)=1×10-14 |
| D、该NaCl溶液中KW=c(H+)?c(OH-)=1×10-12 |
已知合成氨反应N2+3H2?2NH3的浓度数据如下:
当用氢气浓度的减少来表示该化学反应速率时,其速率[mol/(L?s)]为( )
| N2 | H2 | NH3 | |
| ′起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末mol/L | 0.6 | 1.8 | 0.8 |
| A、0.2 | B、0.4 |
| C、0.6 | D、0.8 |
下列叙述正确的是( )
| A、离子化合物中必须含有金属阳离子 |
| B、物质中化学键被破坏,则一定发生化学变化 |
| C、NaCl的结构式为Na-Cl |
| D、H2O的沸点高于H2S |