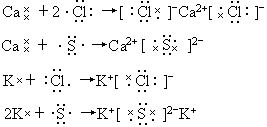题目内容
有A,B,C,D四种元素,A的正二价离子与Ar的电子层结构相同;B原子有三个电子层,其单质为双原子分子;C的核外电子比A少一个,D与B同周期,其单质为淡黄色固体.
(1)写出A,B,C,D的离子符号.
(2)A,B,C,D的离子半径由小到大的顺序是怎样的?
(3)用电子式表示这四种元素中两两形成离子化合物的过程.
答案:
解析:
提示:
解析:
|
【解答】(1)A为时Ca2+,B为Cl-,C为K+,D为S2-. (2)r(Ca2+)<r(K+)<r(Cl-)<r(S2-) (3) 【巧解导析】本题考查原子结构,核外电子排布、离子半径的比较及电子式的书写等知识的综合运用. 因A的正二价离子与Ar的电子层结构相同,可知A为Ca.B原子有三个电子层,其单质为双原子分子,故应为第三周期的元素Cl.C核外电子比A少一个,故A为K.D与B同周期,其单质为淡黄色固体,可知D为S.故它们形成的离子分别为Ca2+,K+,Cl-,S2-.因这些离子具有相同的电子层结构,故核电荷数多者半径小,可知离子半径由小到大的顺序为Ca2+<K+<Cl-<S2-. |
提示:
|
【巧解点悟】解题的关键是能够运用元素周期表的知识判断出元素的符号,并能正确书写电子式,否则易错. |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目