题目内容
5.写出下列物质在水溶液中的电离方程式:氢氧化钡Ba(OH)2=Ba2++2OH-;硫酸铁Fe2(SO4)3=2Fe3++3SO42-.分析 氢氧化钡为强碱,属于强电解质,完全电离;
硫酸铁为盐,属于强电解质,完全电离;
解答 解:氢氧化钡为强碱,属于强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-;
硫酸铁为盐,属于强电解质,完全电离,电离方程式:Fe2(SO4)3=2Fe3++3SO42-;
故答案为:Ba(OH)2=Ba2++2OH-;Fe2(SO4)3=2Fe3++3SO42-.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意强电解质完全电离,用等号,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
15.某温度下,反应SO2(g)+$\frac{1}{2}$O2(g)═SO3(g) 的平衡常数为K1,在同一温度下,反应2SO3(g)═2SO2(g)+O2(g)的平衡常数为K2,则( )
| A. | K2=K1 | B. | K2=$\frac{1}{{K}_{1}}$ | C. | K2=K${\;}_{1}^{2}$ | D. | K2=$\frac{1}{{K}_{1}^{2}}$ |
16.关于能源,下列说法错误的是( )
| A. | 能源的开发和利用情况,可以衡量一个国家或地区的科学技术水平 | |
| B. | 目前新能源主要有:煤、石油、天然气、太阳能、氢能、风能等 | |
| C. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| D. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 |
10.对Na2O和Na2O2的叙述正确的是( )
| A. | Na2O与Na2O2均可与盐酸反应,故二者皆为碱性氧化物 | |
| B. | Na2O与Na2O2不可以相互转化 | |
| C. | 取一块金属钠放在燃烧匙里加热,金属先熔化,燃烧时火焰呈黄色,生成淡黄色固体 | |
| D. | 在呼吸面具中,Na2O2常作供氧剂,而Na2O不能 |
17.下列离子方程式正确的是( )
| A. | 硅酸钠溶液与足量CO2反应:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-═CO32-+H2O |
15.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)?Y(g)+Z (s),以下不能作为反应达到平衡标志的是( )
| A. | X的分解速率是Y的消耗速率 的2倍 | |
| B. | 混合气体的压强不再变化 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解2mol X |
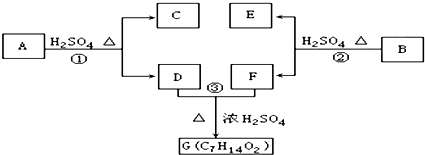
 ;
; ;
; ;写出生成G的化学方程式CH3CH2CH2COOH+
;写出生成G的化学方程式CH3CH2CH2COOH+