题目内容
Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ和Ⅳ。

化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
CH3—CH==CH—CH2—CH3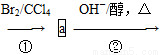 CH2==CH—CH==CH—CH3
CH2==CH—CH==CH—CH3
(1)a的结构简式是________________;②的反应类型是____________。
(2)写出反应①的化学方程式________________,该反应类型是________。
(3)①用甲醇与某有机物发生酯化反应可合成化合物Ⅱ,写出该反应的化学方程式________________________________________________________。
②化合物Ⅱ与新制的氢氧化铜悬浊液反应的化学反应方程式为___________。
(4)化合物Ⅳ是Ⅲ的同分异构体,也有同样的六元环,Ⅳ的结构简式为______。
(1)  消去反应
消去反应
(2)CH3—CH==CH—CH2—CH3+Br2
 加成反应
加成反应
(3)①OHC—CH==CH—COOH+CH3OH OHC—CH==CH—COOCH3+H2O
OHC—CH==CH—COOCH3+H2O
②OHC—CH==CH—COOCH3+2Cu(OH)2+NaOH NaOOC—CH==CH—COOCH3+Cu2O↓+3H2O
NaOOC—CH==CH—COOCH3+Cu2O↓+3H2O
(4) 
【解析】 CH3—CH==CH—CH2—CH3与溴发生加成反应生成 ;卤代烃发生消去反应生成化合物Ⅰ。题目所给信息主要是二烯烃的1,4?加成,
;卤代烃发生消去反应生成化合物Ⅰ。题目所给信息主要是二烯烃的1,4?加成, 反应时,所有的碳碳双键全部打开,②③结合形成新的碳碳双键,①⑤、④⑥结合或①⑥、④⑤结合可形成两种六元环烯烃,也就是Ⅲ和Ⅳ。
反应时,所有的碳碳双键全部打开,②③结合形成新的碳碳双键,①⑤、④⑥结合或①⑥、④⑤结合可形成两种六元环烯烃,也就是Ⅲ和Ⅳ。

某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质。某小组在实验室中用浸出-萃取法制备硫酸铜:

(1)操作Ⅰ为________。操作Ⅱ用到的玻璃仪器有烧杯、________。
(2)操作Ⅱ、操作Ⅲ的主要目的是________、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80 ℃、200 ℃、300 ℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2 mol·L-1 盐酸、1 mol·L-1 H2SO4、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1 BaCl2溶液、蒸馏水。仪器和用品自选。
实验步骤 | 预期现象和结论 |
步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,______________________ | ____________,说明悬浊液中混有Cu4(OH)6SO4 |
步骤2:另取少量悬浊液于试管中,____________________ | ____________,说明悬浊液中混有Cu(OH)2 |
(4)上述实验需要100 mL 0.5 mol·L-1的CuSO4溶液,配制时需称取________g CuSO4·5H2O(相对分子质量:250)。





