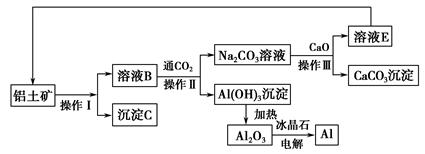
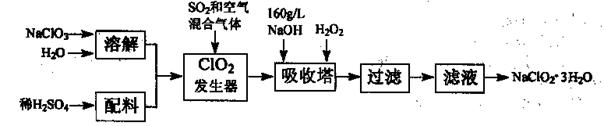
题目内容
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成为是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: 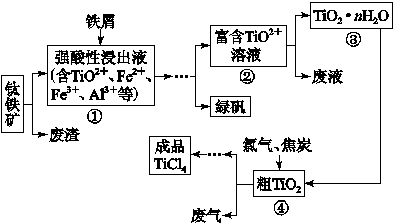
回答下列问题:
往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可以制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4的,可采用 方法。
| | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
(12分,每空2分) (1)使Fe3+还原为Fe2+;生成Ti3+,保护Fe2+不被氧化
(2)10-9m~10-7m(其他合理答案也可) (3)2.79×103
(4)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(5)产生三废(其他合理答案也可) (6)蒸馏(或分馏,或精馏)
解析试题分析:(1)根据题意给出方程式分析铁屑的作用就是作为还原剂的,即:将Fe3+还原为Fe2+,另外浸出液显紫色,说明含有Ti3+,防止Ti3+被Fe3+氧化成TiO2+。参考答案中“生成Ti3+保护Fe2+不被氧化。”有点让人费解,能不能说成“防止Ti3+被Fe3+氧化成TiO2+”或者说“将TiO2+还原成Ti3+”。
(2)形成TiO2·n H2O溶胶,说明得到是胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm~100nm)。
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH—)=2.79×10—39,25℃时,c(H+)×c(OH—)=Kw=1×10—14;反应Fe (OH)3+3H+ Fe3++H2O的平衡常数K=
Fe3++H2O的平衡常数K= =
= =
= =2.79×103。
=2.79×103。
(4)①TiO2 (s)+2Cl2 (g)═TiCl4(l)+O2(g) △H=+140KJ?mol-1 ;②2C(s)+O2(g)═2CO(g) △H=-221KJ?mol-1,依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g),则反应热△H=+140KJ?mol-1-221KJ?mol-1=-81KJ?mol-1。
(5)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等。
(6)由表中信息可以看出,SiCl4、TiCl4两者的沸点相差较大,要精制含少量SiCl4杂质的TiCl4可用蒸馏(或分馏)等方法。
考点:考查工艺流程题的有关判断
点评:该题是典型的化工流程题,问题设置不难,涉及到氧化还原反应、绿色化学、胶体、物质分离提纯,平衡常数计算,溶度积常数的计算应用,盖斯定律的计算应用等。主要是考查学生阅读题目获取信息能力和知识的迁移能力,有利于调动学生的学习兴趣,激发学生的学习积极性,提高学生的应试能力和学科素养。答题时注意基础知识的掌握利用,注意相关知识的积累和总结。

高锰酸钾是一种重要的化工产品。如图是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与(填字母)相似。
| A.75%酒精 | B.O3 | C.二氧化硫 | D.漂白粉 |
(3)上述流程中可以循环使用的物质有CO2、 和 。(填化学式)
(4)若不考虑制备过程中的损失和整套装置的物质循环,则1 molMnO2可制得___gKMnO4。
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)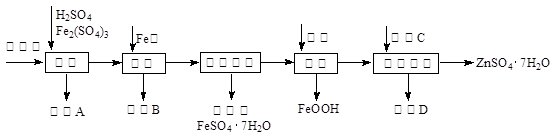
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
(1)下列化肥属于氮肥的是__________。
| A.NH4Cl | B.KCl | C.(NH4)2SO4 | D.K2SO4 |
H.NH4HCO3 I.草木灰
(2)上述化肥中,不能跟草木灰等碱性肥料混合施用的是____________。
下列使用化肥、农药的描述中正确的是( )
| A.高温多雨时比较适合施用钾肥 |
| B.长期施用硫铵会造成土壤板结 |
| C.石硫合剂必须与硫酸混合后才能施用 |
| D.草木灰可以和铵态氮肥一块施用 |