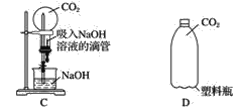
题目内容
【题目】甲醇是一种新型的汽车动力燃料。回答下列问题:
⑴工业上可通过![]() 和
和![]() 化合来制备甲醇。已知某些化学键的键能数据如下表:
化合来制备甲醇。已知某些化学键的键能数据如下表:
化学键 |
|
|
|
|
|
键能 | 413 | 436 | 358 | 1072 | 463 |
已知![]() 中的
中的![]() 与
与![]() 之间为三键,则工业制备甲醇的热化学方程式为________。
之间为三键,则工业制备甲醇的热化学方程式为________。
⑵某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为![]() 的密闭容器内充入
的密闭容器内充入![]() 和
和![]() ,加入合适催化剂(体积可以忽略不计),在
,加入合适催化剂(体积可以忽略不计),在![]() 时开始反应,并用压力计监测容器内压强的变化如下表:
时开始反应,并用压力计监测容器内压强的变化如下表:
反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 |
压强/ | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到![]() 时,以
时,以![]() 表示的平均反应速率
表示的平均反应速率![]() ________,该温度下平衡常数
________,该温度下平衡常数![]() ________
________![]() ,若升高温度,则
,若升高温度,则![]() 值________(填“增大”“减小”或“不变")。
值________(填“增大”“减小”或“不变")。
⑶模拟工业合成甲醇的反应,下图是4种投料比![]() 分别为
分别为![]() 、
、![]() 、
、![]() 、
、![]() 下,反应温度对
下,反应温度对![]() 平衡转化率影响的曲线。
平衡转化率影响的曲线。

①曲线![]() 对应的投料比为________。
对应的投料比为________。
②当曲线![]() 、
、![]() 、
、![]() 对应的投料比达到相同的
对应的投料比达到相同的![]() 平衡转化率时,对应的反应温度与投料比的关系是________。
平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为![]() 、反应温度为
、反应温度为![]() 时,平衡混合气中
时,平衡混合气中![]() 的物质的量分数是________(精确到
的物质的量分数是________(精确到![]() )。
)。
【答案】![]()
![]() 4 减小 5:9 投料比越大,反应温度越低 20.8%
4 减小 5:9 投料比越大,反应温度越低 20.8%
【解析】
⑴根据焓变等于断键吸收的能量减去成键放出的能量进行计算。
⑵建立三段式,根据压强之比等于物质的量之比计算消耗的量,再计算速率和平衡常数,利用平衡移动原理分析。
⑶①理解为n(CO)不变,不断增加氢气的物质的量,平衡正向移动,CO转化率增大;
②根据图像得出对应的反应温度与投料比的关系;
③投料比为![]() 、反应温度为
、反应温度为![]() 时,CO的转化率为75%,建立三段式进行计算。
时,CO的转化率为75%,建立三段式进行计算。
⑴根据焓变等于断键吸收的能量减去成键放出的能量,因此工业制备甲醇的热化学方程式为![]()
![]() ;故答案为:
;故答案为:![]()
![]() 。
。
⑵ ,则从反应开始到
,则从反应开始到![]() 时,压强之比等于物质的量之比,因此
时,压强之比等于物质的量之比,因此![]() ,解得x=0.5,以
,解得x=0.5,以![]() 表示的平均反应速率
表示的平均反应速率![]() ,该温度下平衡常数
,该温度下平衡常数 ,该反应是放热反应,升高温度,平衡向吸热反应方向移动,即逆向移动,
,该反应是放热反应,升高温度,平衡向吸热反应方向移动,即逆向移动,![]() 值减小;故答案为:
值减小;故答案为:![]() ;4;减小。
;4;减小。
⑶①下图是4种投料比![]() 分别为
分别为![]() 、
、![]() 、
、![]() 、
、![]() 下,可以理解为n(CO)不变,不断增加氢气的物质的量,平衡正向移动,CO转化率增大,因此曲线
下,可以理解为n(CO)不变,不断增加氢气的物质的量,平衡正向移动,CO转化率增大,因此曲线![]() 对应的投料比为5:9;故答案为:5:9。
对应的投料比为5:9;故答案为:5:9。
②当曲线![]() 、
、![]() 、
、![]() 对应的投料比达到相同的
对应的投料比达到相同的![]() 平衡转化率时,根据图像得出对应的反应温度与投料比的关系是投料比越大,反应温度越低;故答案为:投料比越大,反应温度越低。
平衡转化率时,根据图像得出对应的反应温度与投料比的关系是投料比越大,反应温度越低;故答案为:投料比越大,反应温度越低。
③投料比为![]() 、反应温度为
、反应温度为![]() 时,CO的转化率为75%,因此有
时,CO的转化率为75%,因此有 ,平衡混合气中
,平衡混合气中![]() 的物质的量分数
的物质的量分数![]() ;故答案为:20.8%。
;故答案为:20.8%。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案