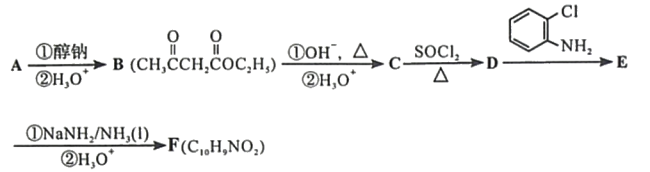
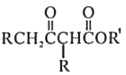
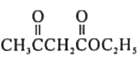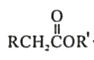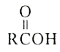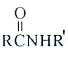题目内容
【题目】利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
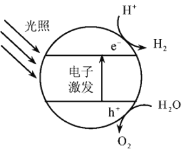
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为___________。
(2)若将该催化剂置于Na2SO3溶液中,产物之一为![]() ,另一产物为__________。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________。
,另一产物为__________。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________。
Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):![]()
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a molL-1和3 a molL-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为___________。
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
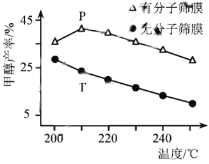
①甲醇平衡产率随温度升高而降低的原因为____________。
②P点甲醇产率高于T点的原因为___________。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为___________°C。
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5) ![]() 的空间构型为__________。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,
的空间构型为__________。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,![]() =1:_______:__________。
=1:_______:__________。
【答案】光能转化为化学能 H2 ![]()
![]() 该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) 分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高 210 平面(正)三角形
该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) 分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高 210 平面(正)三角形 ![]()
![]()
【解析】
I.根据图示分析反应以及能量转化形式;根据氧化还原反应的规律分析产物、书写离子反应式;
II.用三段式和平衡常数表达式计算平衡常数,依据外界条件对化学平衡的影响分析作答;
III.用价层电子对互斥理论判断![]() 的空间构型,利用电离平衡常数表达式计算粒子浓度的比值。
的空间构型,利用电离平衡常数表达式计算粒子浓度的比值。
I.(1)根据图示,该催化剂在水中发生光催化反应的方程式为2H2O 2H2↑+O2↑,光解水能量转化形式为光能转化为化学能,故答案为:光能转化为化学能。
2H2↑+O2↑,光解水能量转化形式为光能转化为化学能,故答案为:光能转化为化学能。
(2)若将该催化剂置于Na2SO3溶液中,产物之一为![]() ,
,![]() 被氧化成
被氧化成![]() ,则H+被还原为H2,即另一产物为H2;若将该催化剂置于AgNO3溶液中,产物之一为O2,氧元素的化合价升高,O2为氧化产物,则生成另一产物的反应为还原反应,由于Ag+得电子能力大于H+,故生成另一产物的离子反应式为Ag++e-=Ag,故答案为:H2,Ag++e-=Ag。
,则H+被还原为H2,即另一产物为H2;若将该催化剂置于AgNO3溶液中,产物之一为O2,氧元素的化合价升高,O2为氧化产物,则生成另一产物的反应为还原反应,由于Ag+得电子能力大于H+,故生成另一产物的离子反应式为Ag++e-=Ag,故答案为:H2,Ag++e-=Ag。
II.(3) CO2和H2的起始浓度分别为 a molL-1和3 a molL-1,CH3OH的产率为b,则生成的CH3OH物质的量浓度为abmol/L,根据三段式

则反应的平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。
(4)①该反应为放热反应(H<0),温度升高,平衡逆向移动(或平衡常数减小),故甲醇平衡产率随温度升高而降低,故答案为:该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小);
②因为分子筛膜能选择性分离出H2O,c(H2O)减小,有利于反应正向进行,甲醇产率升高,故P点甲醇产率高于T点,故答案为:分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高。
③根据图示,使用该分子筛膜210℃时甲醇的产率最大,故在此条件下采用该分子筛膜时的最佳反应温度为210℃,故答案为:210。
III.(5)![]() 中C的孤电子对数为
中C的孤电子对数为![]() ×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C上没有孤电子对,故
×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C上没有孤电子对,故![]() 的空间构型为平面正三角形;H2CO3
的空间构型为平面正三角形;H2CO3![]() 、
、![]() H++
H++![]() ,则Ka1=
,则Ka1=![]() 、Ka2=
、Ka2=![]() ,当溶液的pH=12时,c(H+)=1×10-12mol/L,将其代入Ka1、Ka2中分别求出c(
,当溶液的pH=12时,c(H+)=1×10-12mol/L,将其代入Ka1、Ka2中分别求出c(![]() )=1012Ka1 c(H2CO3)、c(
)=1012Ka1 c(H2CO3)、c(![]() )=1012Ka2 c(
)=1012Ka2 c(![]() )=1024Ka1Ka2 c(H2CO3),则c(H2CO3):c(
)=1024Ka1Ka2 c(H2CO3),则c(H2CO3):c(![]() ):c(
):c(![]() ) =1:(1012Ka1):(1024Ka1Ka2),故答案为:平面正三角形,1012Ka1,1024Ka1Ka2。
) =1:(1012Ka1):(1024Ka1Ka2),故答案为:平面正三角形,1012Ka1,1024Ka1Ka2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样 | 所加试剂 | 实验现象 |
第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
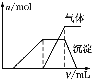
第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如图 |
|
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是____,不能确定的离子有___。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:____。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:
①最初发生的离子反应____。
②最后发生的离子反应____。
(4)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是_____。