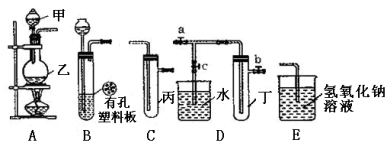
题目内容
【题目】Favorskii反应是化工生产中的重要反应,它是利用炔烃与羰基化合物在强碱性下发生反应,得到炔醇,反应原理为:
以下合成路线是某化工厂生产流程的一部分:

已知:
请回答下列问题:
(1)写出F中官能团的名称 。
(2)写出D的名称(系统命名) 。
(3)④的反应类型是 ;B的结构简式是 。
(4)写出反应⑥的化学方程式为 。
(5)已知H与D互为同分异构体, H属于炔烃,其核磁共振氢谱有3种吸收峰,则H的结构简式为: (任写一种)。
(6)有关C的说法正确的是
a.能使溴的四氯化碳溶液褪色 b.能和氢氧化钠溶液反应
c.能使酸性高锰酸钾褪色 d.能与乙酸发生酯化反应
【答案】(1)羟基、羧基
(2)2-甲基-1,3-丁二烯
(3)加成反应;CH3C(CH3)(OH)C≡CH(或![]() )
)
(4)
(5)(CH3)2CHC≡CH或CH3CH2C≡CCH3
(6)acd
【解析】
试题分析:![]() 与HC≡CH发生加成反应得到B:
与HC≡CH发生加成反应得到B:![]() ;B与H2在Pd催化作用下发生加成反应得到C:
;B与H2在Pd催化作用下发生加成反应得到C:![]() ;C在Al2O3作用下发生消去反应得到D:
;C在Al2O3作用下发生消去反应得到D:![]() ;A与HCN发生加成反应得到E
;A与HCN发生加成反应得到E![]() ;E在酸性溶液中水解得到F:
;E在酸性溶液中水解得到F: ;F发生缩聚反应得到G:
;F发生缩聚反应得到G: 。
。
(1)根据分析可知,F为 ,其分子中含有的官能团为:羟基(-OH)、羧基(-COOH),
,其分子中含有的官能团为:羟基(-OH)、羧基(-COOH),
(2)D的结构简式为:![]() ,属于二烯烃,根据系统命名法,其名称为:2-甲基-1,3-丁二烯,
,属于二烯烃,根据系统命名法,其名称为:2-甲基-1,3-丁二烯,
(3)④的反应就为A与HCN发生加成反应得到E![]() ;根据分析 可知,B的结构简式为:
;根据分析 可知,B的结构简式为:![]() ,
,
(4)反应⑥为F发生缩聚反应得到G ,反应的化学方程式为:
,反应的化学方程式为: ,
,
(5)H是D的同分异构体,核磁共振氢谱有3种峰且属于炔烃的结构简式为:(CH3)2CHC≡CH、CH3CH2CC≡CH3,故答案为:(CH3)2CHC≡CH;CH3CH2CC≡CH3;
(6)C为CH3C(CH3)(OH)CH=CH2,有关C的说法中,a.C中有碳碳双键,能使溴的四氯化碳溶液褪色,故a正确;b.C中醇羟基不能和氢氧化钠溶液反应,故b错误;c.C中有碳碳双键和醇羟基,能使酸性高锰酸钾褪色,故c正确;d.C中醇羟基能与乙酸发生酯化反应,故d正确;故答案为:acd。

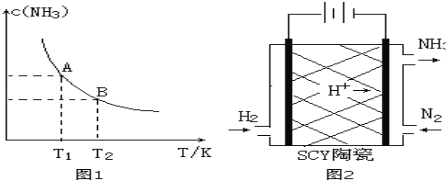
【题目】(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
①当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol 2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol 2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)