题目内容
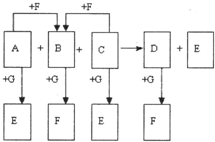 (2010?金华模拟)已知图中所有物质均为化合物,A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色.A、D的水溶液都有杀菌消毒作用. A、B、C反应时,物质的量之比为3:2:4.其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整).请写出:
(2010?金华模拟)已知图中所有物质均为化合物,A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀,化合物G在常温下呈气态,其水溶液是一种常见的强酸,A、C、D、E焰色反应呈黄色.A、D的水溶液都有杀菌消毒作用. A、B、C反应时,物质的量之比为3:2:4.其它物质相互间的转化关系如图所示(各反应在常温下即可发生;多数反应的生成物没有写完整).请写出:(1)A的化学式
NaCl0
NaCl0
,C的电子式: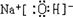
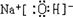
(2)A、B、C三者发生反应的离子方程式:
3NaCl0+2Fe(OH)3+4NaOH=2Na2Fe04+3NaCl+5H20
3NaCl0+2Fe(OH)3+4NaOH=2Na2Fe04+3NaCl+5H20
(3)已知D和G反应时还有使带火星的木条复燃的气体产生,则D和G反应的化学方
程式为:
4Na2Fe04+20HCl=302↑+4FeCl3+8NaCl+10H20
4Na2Fe04+20HCl=302↑+4FeCl3+8NaCl+10H20
.分析:A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀判断为Fe(OH)3,化合物G在常温下呈气态,其水溶液是一种常见的强酸,判断G为HCl,A、C、D、E焰色反应呈黄色,说明都是钠的化合物,A、D的水溶液都有杀菌消毒作用,判断A为NaClO,C为NaOH,D为氢氧化铁被次氯酸根离子在碱性条件下氧化为高铁酸钠;A+G=E,C+G=E,说明E为NaCl;B+G=F,D+G=F,推断F为FeCl3,A、B、C反应时,物质的量之比为3:2:4;依据物质的量之比写出化学方程式;
解答:解:A、C的水溶液呈碱性,且C是一种强碱,F、G的水溶液呈酸性.B为红褐色沉淀判断为Fe(OH)3,化合物G在常温下呈气态,其水溶液是一种常见的强酸,判断G为HCl,A、C、D、E焰色反应呈黄色,说明都是钠的化合物,A、D的水溶液都有杀菌消毒作用,判断A为NaClO,C为NaOH,D为氢氧化铁被次氯酸根离子在碱性条件下氧化为高铁酸钠;A+G=E,C+G=E,说明E为NaCl;B+G=F,D+G=F,推断F为FeCl3,
(1)依据推断A为次氯酸钠,化学式为:NaCl0;C为氢氧化钠电子式为: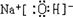 ;
;
故答案为: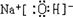 ;
;
(2)A、B、C反应时,物质的量之比为3:2:4,
依据物质的量和原子守恒写出:3NaCl0+2Fe(OH)3+4NaOH=2Na2Fe04+3NaCl+5H20;
故答案为:3NaCl0+2Fe(OH)3+4NaOH=2Na2Fe04+3NaCl+5H20;
(3)D和G反应时生成F,同时还有使带火星的木条复燃的气体产生,依据氧化还原反应和原子守恒写出化学方程式为:
4Na2Fe04+20 HCl=302↑+4FeCl3+8NaCl+10H20;
故答案为:4Na2Fe04+20 HCl=302↑+4FeCl3+8NaCl+10H20;
(1)依据推断A为次氯酸钠,化学式为:NaCl0;C为氢氧化钠电子式为:
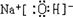 ;
;故答案为:
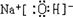 ;
;(2)A、B、C反应时,物质的量之比为3:2:4,
依据物质的量和原子守恒写出:3NaCl0+2Fe(OH)3+4NaOH=2Na2Fe04+3NaCl+5H20;
故答案为:3NaCl0+2Fe(OH)3+4NaOH=2Na2Fe04+3NaCl+5H20;
(3)D和G反应时生成F,同时还有使带火星的木条复燃的气体产生,依据氧化还原反应和原子守恒写出化学方程式为:
4Na2Fe04+20 HCl=302↑+4FeCl3+8NaCl+10H20;
故答案为:4Na2Fe04+20 HCl=302↑+4FeCl3+8NaCl+10H20;
点评:本题考查了物质转化关系和物质性质的应用,充分利用题干条件综合分析转化关系是解题关键,题目难度较大.

练习册系列答案
相关题目
 (2010?金华模拟)白藜芦醇广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是( )
(2010?金华模拟)白藜芦醇广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是( )