题目内容
(8分)(1) 在25℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.7 kJ,则该反应的热化学方程式应为 。
(2).由氢气和氧气反应生成1 mol液态水时放热285.8 kJ,写出该反应的热化学方程式____________________________________。若1g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g) + O2(g) === 2H2O(g)的△H=_______________。
(8分)(1)2CH3OH(l)+3O2(g) ="==" 2CO2(g)+4H2O(l) ?H=" -1452.8" kJ·mol-1
或者 CH3OH(l)+
CH3OH(l)+ O2(g) ="=="
O2(g) ="=="  CO2(g)+
CO2(g)+  H2O(l) ?H=" -22.7" kJ·mol-1
H2O(l) ?H=" -22.7" kJ·mol-1
(本题3分,状态没注明,不给分,?H符号,热值,单位错各扣1分,)
(2) H2(g)+ O2(g)="==" H2O( l ) DH=-285.8 kJ·mol-1; △H= - 483.6 kJ·mol-1
O2(g)="==" H2O( l ) DH=-285.8 kJ·mol-1; △H= - 483.6 kJ·mol-1
解析

(15分)某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,HA的电离度为0.10;在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
|
25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
|
在水中,HA === H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
|
在苯中,2HA == (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1= 。
(2)25℃,该水溶液的pH为 ,在苯体系中HA的转化率为__________。
(3)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足 ,则反应向_______方向进行。
,则反应向_______方向进行。
(4)在苯中,HA自发进行发生二聚:2HA (HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。
(HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。

(5)下列有关该混合体系说法不正确的是 。
A.用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,则上述平衡均正移,且c(HA)均减小。
B.升高温度,HA的电离平衡常数K1和2HA  (HA)2的平衡常数K2均变大。
(HA)2的平衡常数K2均变大。
C.若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度。
D.在25℃时,若再加入一定量的HA固体,则水和苯中HA的起始总浓度之比仍为3:4。
(6)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液,请在下图中画出滴定曲线示意图。

 BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).
BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).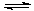 H++ SO42-
H++ SO42-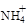 的废水会发生如下反应:
的废水会发生如下反应: