题目内容
12.下列有关物质性质的说法错误的是( )| A. | 热稳定性:HCl>HI | B. | 非金属性:S>O | ||
| C. | 酸性:H2SO4>H3PO4 | D. | 原子半径:Na>Mg |
分析 A.非金属性越强,对应氢化物越稳定;
B.同主族从上到下非金属性减弱;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.同周期从左向右原子半径减小.
解答 解:A.非金属性Cl>I,对应氢化物的稳定性为HCl>HI,故A正确;
B.同主族从上到下非金属性减弱,则非金属性:S<O,故B错误;
C.非金属性S>P,对应最高价含氧酸的酸性为H2SO4>H3PO4,故C正确;
D.同周期从左向右原子半径减小,则原子半径:Na>Mg,故D正确;
故选B.
点评 本题考查周期表和周期律的应用,为高频考点,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
2.将等物质的量的乙酸、丙酸、正丁酸(CH3CH2CH2COOH)和正戊酸(CH3CH2CH2CH2COOH)及季戊四醇(结构式如图)混合,在催化剂作用下生成的四羧酸季戊四醇酯(不考虑立体异构)有( )

| A. | 15种 | B. | 16种 | C. | 20种 | D. | 24种 |
3.一定温度下,在1L密闭容器中,反应N2+3H2?2NH3达到化学平衡状态的标志是( )
| A. | N2:H2:NH3=1:3:2 | |
| B. | N2、H2、NH3的物质的量不再改变 | |
| C. | 混合气体的密度保持不变 | |
| D. | 单位时间里每增加1mol N2,同时增加3mol H2 |
20.下列实验正确的是( )
| A. |  蒸发、浓缩 | B. |  检查装置气密性 | ||
| C. |  碳酸氢钠受热分解 | D. |  分离沸点不同且互溶的液体混合体 |
7.海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益.下列关于海水资源的说法中,错误的是( )
| A. | 海带中含有碘元素 | |
| B. | 海水中含有大量氯元素 | |
| C. | 蒸馏法是海水淡化的主要方法之一 | |
| D. | 开发海水资源可以不考虑是否对环境有污染 |
17.0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式正确的是( )
| A. | c(H+)>c(F-) | B. | c(H+)>c(HF) | C. | c(OH-)>c(H+) | D. | c(F-)>c(HF) |
4.下列说法正确的是( )
| A. | 分子式为C9H10且含有碳碳双键的芳香烃有5种 | |
| B. | 结构为…-CH═CH-CH═CH-CH═CH-…的高分子化合物,其单体是乙烯 | |
| C. | 三分子甲醛合成三聚甲醛( )的反应属于加成反应 )的反应属于加成反应 | |
| D. | 丙烯酸(CH2═CHCOOH)和山梨酸(CH3CH═CHCH═CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物 |
1.下列说法不正确的是( )
| A. | 物质的沸点:正戊烷>异戊烷>新戊烷 | |
| B. | 相同条件下与钠反应的剧烈程度: > > >CH3OH >CH3OH | |
| C. | 常温常压下各物质的密度: > > >H2O>CH3COOCH2CH3 >H2O>CH3COOCH2CH3 | |
| D. | 常温下物质在水中的溶解性:CH3CH2OH> >CH3CH3 >CH3CH3 |
2.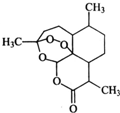 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 有“-O-”键,分子式C15H22O5,可发生取代反应 | |
| B. | 有“六元环”结构,是苯的同系物,可发生加成反应 | |
| C. | 有“-O-O-”键,氧化性较强,可发生还原反应 | |
| D. | 有“-COOC-”键,碱性条件下,可发生水解反应 |