题目内容
某些同学在学习了氨的性质时探究讨论:既然氨气具有还原性,能否像H2那样还原CuO 呢?(一)制取氨气
(1)写出实验室制取氨气的化学方程式:
(2)有一同学模仿排饱和食盐水收集氯气的方法用排饱和氯化铵溶液的方法收集氨气.但另一同学认为他不能达到目的,理由是
(二)该小组某同学设计如图装置(夹持及尾气入理装置未画出),探究氨气的还原性:
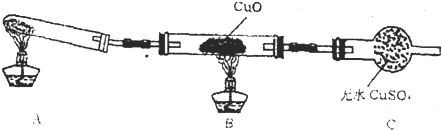
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(2)利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,氨气与CuO反应的化学方程式为
(三)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O,已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu
| H+ |
分析:(1)实验室用氯化铵和氢氧化钙在加热条件下反应制备氨气;
(2)氯气在饱和食盐水中溶解度很小,氨气极易溶于水,在氯化铵溶液溶解度也很大;
(二)(1)A中制得的氨气中含有水蒸气,直接通入加热的B会炸裂试管;
(2)CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明氨气与氧化铜反应生成铜、水、氮气,根据得失电子守恒配平方程式;
(三)若红色物质只有铜,不溶于稀硫酸,若红色物质含有Cu2O,因为Cu+的稳定性比Cu2+差(Cu
Cu+Cu2+),所以溶液会显蓝色.
(2)氯气在饱和食盐水中溶解度很小,氨气极易溶于水,在氯化铵溶液溶解度也很大;
(二)(1)A中制得的氨气中含有水蒸气,直接通入加热的B会炸裂试管;
(2)CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明氨气与氧化铜反应生成铜、水、氮气,根据得失电子守恒配平方程式;
(三)若红色物质只有铜,不溶于稀硫酸,若红色物质含有Cu2O,因为Cu+的稳定性比Cu2+差(Cu
| H+ |
解答:(一)(1)氨气的实验室制备原理:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2,故答案为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;
(2)氯气能用排饱和食盐水收集原因:氯气本身在水中的溶解度不大,又因为存在Cl2+H2O H++Cl-+HClO,饱和食盐水中氯离子浓度大,抑制了氯气的溶解;而氨气极易溶于水,在氯化铵溶液溶解度也很大,氯化铵对氨气在水中的溶解度影响不大,所以不能排饱和氯化铵法收集氨气,
故答案为:氨气极易溶于水,氯化铵对氨气在水中的溶解度影响不大;
(二)(1)根据制备氨气的反应原理可知,从A处出来的氨气中含有水分,通入加热的B中会炸裂硬质试管,应该在A和B之间加一个干燥装置,氨气是碱性气体,应该用碱性干燥剂,可选用盛有碱石灰的干燥管,故答案为:在装置A与B之间增加装有碱石灰的干燥管;
(2)根据现象可以判断氨气与氧化铜反应生成铜、水、氮气,依据得失电子守恒配平方程式得:3CuO+2NH3
3Cu+3H2O+N2,
故答案为:3CuO+2NH3
3Cu+3H2O+N2;
(三)铜的活泼性排在氢的后面,所以如果红色物质只有铜,加硫酸不溶解,溶液颜色,不变;如果含有Cu2O,Cu+的稳定性比Cu2+差(Cu
Cu+Cu2+),加硫酸后溶液显蓝色,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
| ||
| ||
(2)氯气能用排饱和食盐水收集原因:氯气本身在水中的溶解度不大,又因为存在Cl2+H2O H++Cl-+HClO,饱和食盐水中氯离子浓度大,抑制了氯气的溶解;而氨气极易溶于水,在氯化铵溶液溶解度也很大,氯化铵对氨气在水中的溶解度影响不大,所以不能排饱和氯化铵法收集氨气,
故答案为:氨气极易溶于水,氯化铵对氨气在水中的溶解度影响不大;
(二)(1)根据制备氨气的反应原理可知,从A处出来的氨气中含有水分,通入加热的B中会炸裂硬质试管,应该在A和B之间加一个干燥装置,氨气是碱性气体,应该用碱性干燥剂,可选用盛有碱石灰的干燥管,故答案为:在装置A与B之间增加装有碱石灰的干燥管;
(2)根据现象可以判断氨气与氧化铜反应生成铜、水、氮气,依据得失电子守恒配平方程式得:3CuO+2NH3
| ||
故答案为:3CuO+2NH3
| ||
(三)铜的活泼性排在氢的后面,所以如果红色物质只有铜,加硫酸不溶解,溶液颜色,不变;如果含有Cu2O,Cu+的稳定性比Cu2+差(Cu
| H+ |
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
点评:本题是实验探究题,考查了氨气的实验室制法和性质,更侧重考查学生分析、设计实验的能力,解题时注意语言叙述的规范性、完整性.

练习册系列答案
相关题目
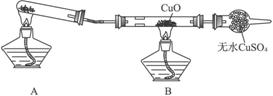
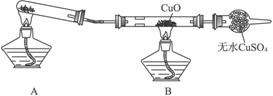
 Na2SO4
+ 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4
+ 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
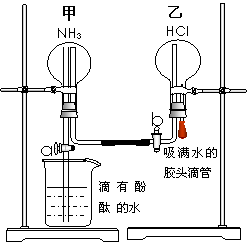 为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们积极思考并设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们积极思考并设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验: