题目内容
在一个容积不变的容器内,有一左右可滑动的隔板,在该密封容器隔板两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A,B,C均为4.0mol,D为2.0mol,E为3.0mol.设F为x,mol,当x在一定范围内变化时,均可通过调节容器的温度使两侧反应达到平衡,并且隔板恰好处于正中位置,请填写下列空白:
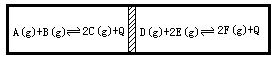
(1)若x=6.0mol,则右侧反应起始时向________(填“逆反应”或“正反应”)方向进行.欲使起始反应维持向该方向进行,则x的取值范围为________.
(2)当x=6.0时,到达平衡时,n(A)________4mol,n(B)________4mol,n(C)________4mol(填“大于”“小于”或“等于”).
答案:
解析:
解析:
|
(1)逆反应, 导解:(1)左侧容器中气体物质的量始终为:4+4+4=12mol,右侧起始各物质的物质的量为2.0+3.0+6.0=11mol<12mol,欲使达到平衡时隔板处于正中央位置,左侧与右侧物质的量应相等,右侧反应必向气体体积增大方向进行,即逆反应方向进行,要维持向该方向进行,则2.0+3.0+x<12,即x<7,要满足到平衡时,气体总物质的量为12mol,则有: D + 2E 开始(mol)2.0 3.0 x 转化(mol)a 2a 2a 平衡(mol)2.0+a 3.0+2a x-2a 解得:x> (2)当x=6.0时,右侧反应逆向进行,须升高温度,对于左侧反应,升高温度反应逆向移动,所以nA>4,nB>4,nC<4. |

练习册系列答案
相关题目
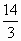 <x<7;(2)大于,大于,小于
<x<7;(2)大于,大于,小于 2F
2F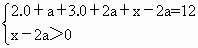
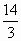 <x<7.
<x<7. (2)当反应达到平衡时,降低温度,A的转化率
(2)当反应达到平衡时,降低温度,A的转化率 