题目内容
【题目】若定义pAg=-lgc(Ag+),pCl=-lgc(Cl-),根据不同温度下氯化银饱和溶液的pAg和pCl可绘制图像如图所示,且已知氯化银的溶解度随温度的升高而增大,根据该图像,下列表述正确的是

A. A点表示的是T1温度下的不饱和溶液
B. 将A点的溶液降温,可能得到C点的饱和溶液
C. 向B点所表示的溶液中加入氯化钠溶液,溶液可能改变至D点
D. T3>T2>T1
【答案】A
【解析】A、过C点的那条直线上所有点都是饱和溶液,过A点作平行y轴直线,在相同pAg, T1温度时,A点达到平衡,需要增加c(Cl-),即A点表示的是T1温度下的溶液为不饱和溶液,故A正确;B、C点的c(Ag+)和c(Cl-)比A点的c(Ag+)和c(Cl-)大,溶液降温,浓度不会增大,故B错误;C、pCl=-lgc(Cl-),加入NaCl溶液,溶液中c(Cl-)增大,而pCl将会减小,因此不可能改变至D点,故C错误;D、pAg=-lgc(Ag+),pCl=-lgc(Cl-)以及氯化银的溶解度随温度的升高而增大,因此推出T1>T2>T3,故D错误。

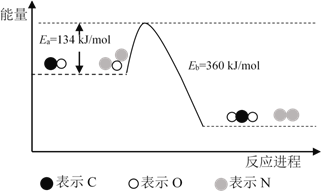
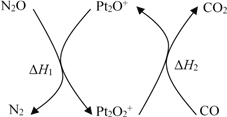
【题目】氮元素也与碳元素一样存在一系列氢化物,如NH3、N2H4、N3H5、N4H6等。请回答下列有关问题:
(1)上述氮的系列氢化物的通式为____________。
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,查阅文献资料,化学键键能如下表:
化学键 | H-H | N=N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
①氨分解反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应
H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea2=___________。
NH3(g)的活化能Ea2=___________。
②氨气完全燃烧生成氮气和气态水的热化学方程式为__________________________。
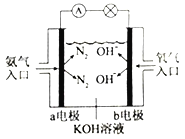
③如右图是氨气燃料电池示意图。a电极的电极反应式为________________。
(3)已知NH3·H2O为一元弱碱。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为:N2H4·H2O+H2O![]() N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为__________________;溶液中离子浓度由大到小的排列顺序为___________________。
(4)通过计算判定(NH4)2SO3溶液的酸碱性(写出计算过程)________________________。(已知:氨水Kb=1.8×10-5;H2SO3 Ka1=1.3×10-2Ka2=6.3×10-8)。
【题目】在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________已知:K300℃>K350℃,则该反应是_______热反应图中表示NO2变化的曲线是__________上述反应在第5s时,NO的转化率为_________。
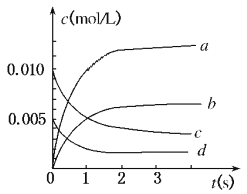
(2)能说明该反应已达到平衡状态的是__________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂