题目内容
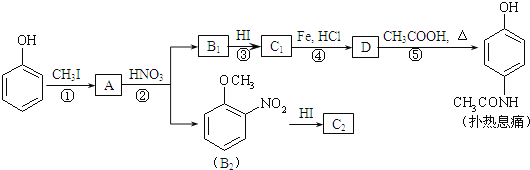
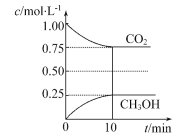
【题目】(1)在一定温度下的2 L固定容积的密闭容器中,通入2 mol CO2和3 mol H2,发生的反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是_____________(填编号)。
A.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1∶1,且保持不变
②若要使K=1,则改变的条件可以是_____________(填选项)。
A增大压强 B减小压强 C升高温度 D降低温度 E加入催化剂
(2)有一种用CO2生产甲醇燃料的方法。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为 。
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)![]() 3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 3 | 0 |
该反应的平衡常数表达式为K=__________。升高温度,平衡常数将__________(填“增大”“减小”或“不变”)。
p>(4)为研究不同条件对反应2NO(g)+Cl2(g)
【答案】
(1)①BC;②D;
(2)CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)ΔH=-(3/2c-a-b)kJ·mol-1;
(3)K=c3(C)/〔c2(A)·c(B)〕;减小;(4)小于;
【解析】
试题分析:①未平衡时是个变量,现在不变说明已经达到平衡状态了。A.单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故A错误;B.未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故B正确;C.未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故C正确;D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;故选BC;
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=![]() =0.20,而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,故答案为:D;
=0.20,而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,故答案为:D;
(2)①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
②CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
③2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
根据盖斯定律,将![]() ×③-①-②得:CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)
×③-①-②得:CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)
ΔH=![]() △H3-△H1-△H2=-(
△H3-△H1-△H2=-(![]() c-a-b)kJ·mol-1,故答案为:
c-a-b)kJ·mol-1,故答案为:
CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)ΔH=![]() △H3-△H1-△H2=-(
△H3-△H1-△H2=-(![]() c-a-b)kJ·mol-1;
c-a-b)kJ·mol-1;
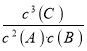 ;恒容压强与温度及其气体物质的量成正比,又由起始D的物质的量为0可知,反应2A(g)+B(g)
;恒容压强与温度及其气体物质的量成正比,又由起始D的物质的量为0可知,反应2A(g)+B(g) ![]() 3C(g)+2D(s),向正反应进行建立平衡,而气体物质的量不变,但压强增大,则说明该反应为放热反应,温度升高导致气体的压强增大。由①的分析得出该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故答案为:
3C(g)+2D(s),向正反应进行建立平衡,而气体物质的量不变,但压强增大,则说明该反应为放热反应,温度升高导致气体的压强增大。由①的分析得出该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故答案为: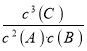 ;减小;
;减小;
(4)正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;故答案为:小于。

 名校课堂系列答案
名校课堂系列答案