题目内容
上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用.下列关于NO的说法错误的是( )
| A、NO是无色易溶于水的气体 |
| B、NO是汽车尾气的有害成分之一 |
| C、NO在人体的血管系统内具有传送信号的功能 |
| D、NO能够与人体血红蛋白结合,造成人体缺氧中毒 |
考点:氮的氧化物的性质及其对环境的影响
专题:氮族元素
分析:A、NO是一种无色无味难溶于水的有毒气体;
B、NO、NO2、CO、碳氢化合物等是汽车尾气的有害成分成分;
C、NO作为信号分子,使血管扩张而帮助控制血液流向人体的各个部位;
D、NO是有毒的气体,呼入人体内会和人体血红蛋白结合,造成人体缺氧中毒;
B、NO、NO2、CO、碳氢化合物等是汽车尾气的有害成分成分;
C、NO作为信号分子,使血管扩张而帮助控制血液流向人体的各个部位;
D、NO是有毒的气体,呼入人体内会和人体血红蛋白结合,造成人体缺氧中毒;
解答:
解:A、NO是一种无色无味难溶于水气体,故A错误;
B、汽车尾气主要是氮氧化物,所以NO是尾气中的有害成分,故B正确;
C、NO是明星分子,在人体的血管系统内具有传送信号的功能,故C正确;
D、NO有毒能结合人体内的血红蛋白,使之丧失运送氧的能力,故D正确;
故选A.
B、汽车尾气主要是氮氧化物,所以NO是尾气中的有害成分,故B正确;
C、NO是明星分子,在人体的血管系统内具有传送信号的功能,故C正确;
D、NO有毒能结合人体内的血红蛋白,使之丧失运送氧的能力,故D正确;
故选A.
点评:本题考查了NO的性质和作用,熟悉物质的性质是解答本题的关键,较简单.

练习册系列答案
相关题目
 如图表示在某容器中,充入N2和H2,在一定条件下N2+3H2?2NH3△H<0的反应达到平衡,当条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡.符合该图变化的条件是( )
如图表示在某容器中,充入N2和H2,在一定条件下N2+3H2?2NH3△H<0的反应达到平衡,当条件改变时原平衡被破坏,反应一段时间后又建立起新的平衡.符合该图变化的条件是( )| A、可逆反应达到平衡后,将NH3液化并建立新的平衡 |
| B、可逆反应达到平衡后,再减小压强并建立新的平衡 |
| C、可逆反应达到平衡后,再降低温度并建立新的平衡 |
| D、可逆反应达到平衡后,再升高温度并建立新的平衡 |
将一定量的某有机物在足量氧气中充分燃烧后的所有产物用足量饱和石灰水完全吸收,得沉淀2g,除去沉淀后的溶液质量比原石灰水质量减少了0.58g.由此推知,该有机物不可能是( )
| A、乙烷 | B、乙醇 |
| C、乙酸乙酯 | D、乙二醇 |
下列说法或表示法正确的是( )
| A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
| C、C(石墨)=C(金刚石)△H>0 所以石墨比金刚石稳定 |
| D、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
硫酸是一种重要的化工产品,2SO2+O2?2SO3是生产过程中的重要反应.下列对于该反应的说法中正确的是( )
| A、只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B、该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| C、如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O只存在于O2和SO3中 |
| D、在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
下列说法正确的是( )
A、钾(K)原子基态的原子结构示意图为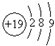 |
B、H2O电子式为 |
| C、Mg的原子基态电子排布式为1s22s22p63s23p1 |
| D、Ca原子基态电子排布式为1s22s22p63s23p6 |
从下列各项可以判断某一元酸是强酸的是( )
| A、该酸可以把CaCO3溶解 |
| B、0.1 mol?L-1该酸溶液中c(OH-)为1×10-12 mol?L-1 |
| C、加热该酸至沸腾也不分解 |
| D、0.1 mol?L-1该酸的pH为1 |
在NO2与水的反应中( )
| A、NO2既有被氧化的又有被还原的 |
| B、NO2在反应中只做了还原剂 |
| C、NO2在反应中只做了氧化剂 |
| D、NO2既是氧化剂又是还原剂 |
已知298K时,N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol,在相同条件下向密闭容器中加入1molN2和3molH2,达到平衡时的反应热为△H1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2、0.1molNH3,达到平衡时的反应热为△H2,则下列关系正确的是( )
| A、△H1=△H2=-92.4 kJ/mol |
| B、-92.4 kJ/mol<△H1<△H2 |
| C、△H1<△H2<-92.4 kJ/mol |
| D、△H1=△H2<-92.4 kJ/mol |