题目内容
10.现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出).请回答下列问题:

(1)写出下列物质B的化学式Al,物质E的名称盐酸
(2)写出下列反应的离子方程式:
反应①2Na+2H2O=2Na++2OH-+H2↑;
反应③2Al+2OH-+2H2O=2AlO2-+3H2↑;
反应⑤Cl2+2Fe2+=2Fe3++2Cl-.
(3)向F溶液中加入D溶液,写出整个反应过程的实验现象先有白色沉淀出现,然后白色沉淀逐渐变为墨绿色最终变为红褐色.
分析 金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2;判断C为Fe,据此答题.
解答 解:金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2,判断C为Fe,
(1)依据分析B为Al,E为盐酸溶液,
故答案为:Al;盐酸;
(2)①反应是钠和水的反应,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
反应③是氢氧化钠和铝反应生成氢气和偏铝酸钠,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
反应⑤是氯化亚铁和氯气反应生成氯化铁的反应,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑;Cl2+2Fe2+=2Fe3++2Cl-;
(3)F为FeCl2,D为NaOH,向F溶液中加入D溶液,生成氢氧化亚铁白色沉淀,在空气中被氧化成氢氧化铁,氢整个反应过程的实验现象是先有白色沉淀出现,然后白色沉淀逐渐变为墨绿色最终变为红褐色,
故答案为:先有白色沉淀出现,然后白色沉淀逐渐变为墨绿色最终变为红褐色.
点评 本题考查了物质转化关系的分析推断,物质性质的应用主要考查常见单质及其化合物的性质应用,题目较简单.

| A. | 以Mg2+为中心的大环配合物叶绿素能催化光合作用 | |
| B. | Fe2+的卟啉配合物是输送O2的血红素 | |
| C. | 三价铁离子和硫氰酸根离子形成的配离子常用于人造血液 | |
| D. | 钴离子的卟啉配合物是人体需要的一种维生素 |
| A. | 过量的铁与浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | |
| B. | 次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:Mg2++2HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O | |
| D. | 1mol•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+═Al(OH)3↓+Al3++H2 O |
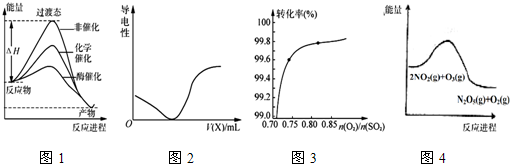
| A. | 由图1所示曲线可知,化学催化比酶催化的效果好 | |
| B. | 在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 | |
| C. | 其它条件不变,关于反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),图3中纵坐标表示O2的转化率 | |
| D. | 图4的反应升高温度,平衡常数减小 |
| A. | 硝酸和氢氧化钠 | B. | 氢氧化铁和盐酸 | C. | 氢氧化钡和硫酸 | D. | 碳酸氢钠和盐酸 |
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
| A. | 沙土 | B. | 水 | C. | 泡沫灭火器 | D. | 煤油 |
